Unterschied zwischen Natriumcyanid und Kaliumcyanid
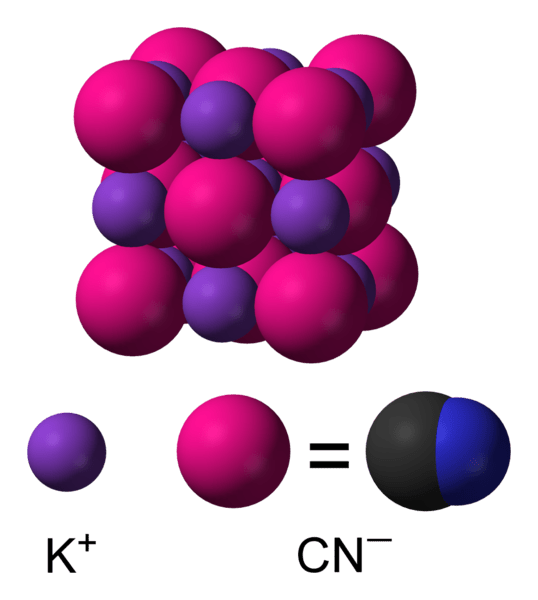
Der Schlüsselunterschied Zwischen Natriumcyanid und Kaliumcyanid ist das Natriumcyanid wird durch Behandlung von Wasserstoffcyanid mit Natriumhydroxid produziert, während Kaliumcyanid durch Behandlung von Wasserstoffcyanid mit Kaliumhydroxid produziert wird.
Natriumcyanid und Kaliumcyanid werden hauptsächlich im Goldabbau verwendet, obwohl es sich um hochgiftige Verbindungen handelt. Diese sind aufgrund ihrer hohen Reaktivität gegenüber Metallen nützlich im Goldabbau. Da sich nur das Kation in den chemischen Formeln dieser beiden Verbindungen unterscheidet und die Kationen aus derselben Gruppe in der Periodenzüchttabelle stammen, weisen sie nahezu ähnliche physikalische und chemische Eigenschaften auf.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Natriumcyanid
3. Was ist Kaliumcyanid
4. Ähnlichkeiten zwischen Natriumcyanid und Kaliumcyanid
5. Seite an Seitenvergleich - Natriumcyanid gegen Kaliumcyanid in tabellarischer Form
6. Zusammenfassung
Was ist Natriumcyanid?
Natriumcyanid ist eine anorganische Verbindung mit der chemischen Formel NACN. Es erscheint als weißer Feststoff und dieser Feststoff ist hoch wasserlöslich. Es hat einen schwachen, mandelähnlichen Geruch. Das Cyanid -Anion hat eine hohe Affinität zu Metallen; Daher ist diese Verbindung gegenüber Metallen sehr reaktiv. Darüber hinaus ist es aufgrund des gleichen Grundes für hohe Reaktivität sehr toxisch. Dies ist eine Salzverbindung, die aus der Reaktion zwischen Wasserstoffcyanidsäure und Natriumhydroxidbase gebildet wird. Natriumcyanid ist jedoch eine mäßig starke Basis. Wenn wir dieser Verbindung etwas Säure hinzufügen, emittiert es Wasserstoff Cyanidgas. Die Molmasse von Natriumcyanid beträgt 49 g/mol. Der Schmelzpunkt ist 563.7 ° C, während der Siedepunkt 1.496 ° C beträgt.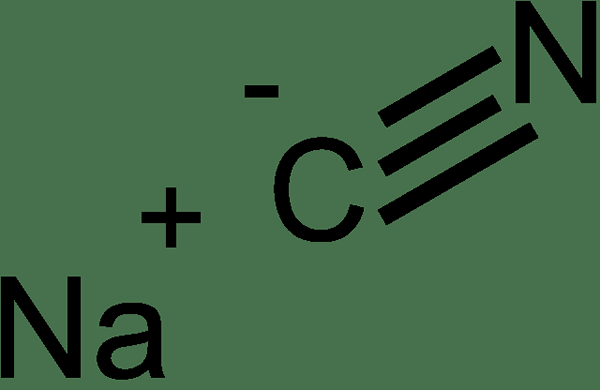
Die Struktur dieser Verbindung ähnelt der Struktur von Natriumchlorid. Jedes Anion und jedes Kationen sind sechs koordinierte Atome in dieser Struktur. Jedes Natriumkation bildet PI -Bindungen mit zwei Cyanidgruppen. Es gibt viele Anwendungen von Natriumcyanid: Gold im Goldabbau als chemischer Ausgangsmaterial für die Herstellung verschiedener Verbindungen wie Cyanuric -Chlorid usw. zu extrahieren.
Was ist Kaliumcyanid?
Kaliumcyanid ist eine anorganische Verbindung mit der chemischen Formel KCN. Es ist ein farbloser kristalline Feststoff, der als Zucker erscheint. Es ist sehr wasserlöslich und auch grallisch. Darüber hinaus ist diese Verbindung sehr giftig. Es hat einen schwachen mandelartigen Geruch. Die Molmasse von Kaliumcyanid beträgt 65.12 g/mol. Sein Schmelzpunkt ist 634.5 ° C, während sein Siedepunkt 1.625 ° C beträgt. Diese Verbindung ist auch ein Salz, das sich aus der Reaktion zwischen Wasserstoffcyanidsäure und Kaliumhydroxidbase bildet. Im Produktionsprozess müssen wir Wasserstoffcyanid mit wässrigem Kaliumhydroxid behandeln, gefolgt von einer Vakuumtrocknung.
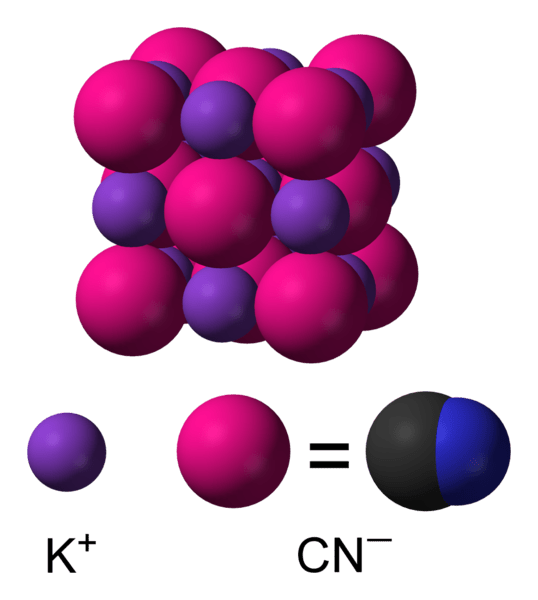
Kaliumcyanid verfügt über viele Anwendungen, einschließlich der Verwendung in der organischen Synthese zur Herstellung von Nitrilen, Verwendung im Goldabbau für die Extraktion von Gold, Elektroplatten, als fotografischer Fixer usw.
Was sind die Ähnlichkeiten zwischen Natriumcyanid und Kalium
Zyanid?
- Sowohl Natriumcyanid als auch Kaliumcyanid sind wichtige Salzverbindungen, die sehr toxisch, aber im Goldabbau sehr nützlich sind.
- Diese Verbindungen haben einen schwachen, mandelähnlichen Geruch.
Was ist der Unterschied zwischen Natriumcyanid und Kaliumcyanid?
Der Schlüsselunterschied zwischen Natriumcyanid und Kaliumcyanid besteht darin. Darüber hinaus erscheint Natriumcyanid als weißer Feststoff, während Kaliumcyanid als farbloser kristalliner Feststoff auftritt, der dem Erscheinungsbild von Zucker ähnelt.
Nachfolgend Infografik tabuliert mehr Vergleiche im Zusammenhang mit dem Unterschied zwischen Natriumcyanid und Kaliumcyanid.

Zusammenfassung -Natriumcyanid gegen Kaliumcyanid
Sowohl Natriumcyanid als auch Kaliumcyanid sind wichtige Salzverbindungen, die sehr toxisch, aber im Goldabbau sehr nützlich sind. Der Schlüsselunterschied zwischen Natriumcyanid und Kaliumcyanid besteht jedoch darin, dass Natriumcyanid durch Behandlung von Wasserstoffcyanid mit Natriumhydroxid produziert wird, während Kaliumcyanid durch Behandlung von Wasserstoffcyanid mit Kaliumhydroxid produziert wird. Hier hat Natriumcyanid ein Natriumkation, das an Cyanidanion gebunden ist, während Kaliumcyanid anstelle des Natriumkation ein Kaliumkation hat.
Referenz:
1. „Natriumcyanid.Wikipedia, Wikimedia Foundation, 4. Oktober. 2019, hier erhältlich.
2. "Kaliumcyanid.”Wikipedia, Wikimedia Foundation, 18. November. 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Natriumcyanid" von EPOP - eigener Arbeit, Public Domain) über Commons Wikimedia
2. "Kalium-Cyanid-Phase-i-i-Unit-Cell-3D-SF" von Ben Mills-eigene Arbeit (Public Domain) über Commons Wikimedia


