Unterschied zwischen löslichen und unlöslichen Salzen

Der Schlüsselunterschied Zwischen löslichen und unlöslichen Salzen ist das Lösliche Salze können sich bei Raumtemperatur in Wasser auflösen, während unlösliche Salze bei Raumtemperatur nicht in Wasser auflösen können.
Ein Salz ist jede Verbindung, die aus der Reaktion zwischen einer Säure und einer Base gebildet wird. Daher enthält ein Salz im Wesentlichen ein Anion (stammt aus der Säure) und ein Kation (kommt von der Basis). Wir können Salzverbindungen je nach Wasserlöslichkeit bei Raumtemperatur in zwei Arten unterteilen. Sie sind lösliche und unlösliche Salze. Die Löslichkeit von Salzen hängt von den Arten von Wechselwirkungen ab, die sie mit Wassermolekülen haben können.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind lösliche Salze
3. Was sind unlösliche Salze
4. Seite an Seitenvergleich - Löslich gegen unlösliche Salze in tabellarischer Form
5. Zusammenfassung
Was sind lösliche Salze?
Lösliche Salze sind Salzverbindungen, die bei Raumtemperatur in Wasser löslich sind. Diese Salzverbindungen lösen sich in Wasser auf, weil sie intermolekulare Anziehungen mit Wassermolekülen bilden können. Wassermoleküle sind polar. Daher ist Wasser ein polares Lösungsmittel, und polare Salze können sich in Wasser auflösen.

Abbildung 01: Natriumchlorid ist ein lösliches Salz
Da Salze ionische Verbindungen sind, lösen sie sich in Wasser auf, weil Wassermoleküle dazu neigen, die Ionen in der Verbindung anzuziehen, was sie voneinander getrennt macht. Hier bildet die Auflösung des Salzes ionische Spezies in Wasser, wodurch die neu gebildete wässrige Lösung hoch leitend ist. Die in Wasser gelöste ionische Spezies kann durch sie Strom leiten. Ein Beispiel für ein lösliches Salz ist Tischsalz oder Natriumchlorid. Eine wässrige Lösung von Tischsalz enthält Natriumionen und Chloridionen.
Was sind unlösliche Salze?
Unlösliche Salze sind Salzverbindungen, die bei Raumtemperatur in Wasser unlöslich sind. Diese sind in Wasser unlöslich, da Wassermoleküle die Ionen in der Salzverbindung nicht anziehen können. Daher gibt es keine intermolekularen Wechselwirkungen zwischen Wassermolekülen und unlöslichen Salzverbindungen.

Abbildung 02: Silberchlorid -Niederschlag in Wasser
Darüber hinaus sind unlösliche Salze unpolare Verbindungen. Im Gegensatz zu löslichen Salzen macht die Mischung von unlöslichen Salzen mit Wasser die Lösung nicht leitfähig, da sich das Salz nicht in Ionen unterscheidet. Ein gutes Beispiel für ein unlösliches Salz ist Silberchlorid (AGCL).
Was ist der Unterschied zwischen löslichen und unlöslichen Salzen?
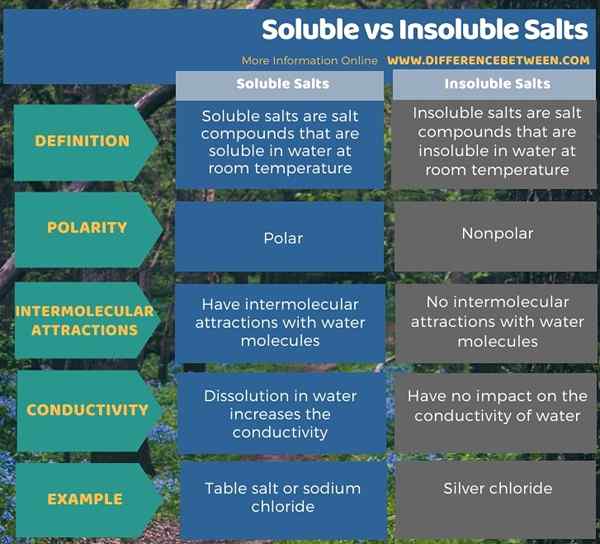
Wir können Salzverbindungen je nach Wasserlöslichkeit in zwei Arten unterteilen. Sie sind lösliche und unlösliche Salze. Der Hauptunterschied zwischen löslichen und unlöslichen Salzen besteht darin, dass sich die löslichen Salze bei Raumtemperatur in Wasser auflösen können, während die unlöslichen Salze bei Raumtemperatur nicht in Wasser auflösen können. Darüber hinaus sind lösliche Salze polar; Deshalb können sie sich in Wasser auflösen, was ein polares Lösungsmittel ist. Im Gegensatz dazu sind unlösliche Salze unpolar. Dies ist also ein weiterer signifikanter Unterschied zwischen löslichen und unlöslichen Salzen.
Zusätzlich zum oben genannten können die Wassermoleküle intermolekulare Anziehungen mit den Ionen von löslichen Salzen bilden, es gibt jedoch keine intermolekularen Wechselwirkungen zwischen unlöslichen Salzen und Wasser. Darüber hinaus ist die Auflösung von löslichen Salzen in Wasser eine hochleitende wässrige Lösung, da die in Wasser gelösten Ionen Strom durch sie leiten können. Im Gegensatz zu löslichen Salzen macht das Mischen von unlöslichen Salzen mit Wasser kein Wasser leitend. Natriumchlorid ist ein Beispiel für lösliche Salze, während Silberchlorid ein Beispiel für unlösliches Salz ist.
Zusammenfassung -lösliche gegen unlösliche Salze
Wir können Salzverbindungen je nach Wasserlöslichkeit in zwei Arten unterteilen. Sie sind lösliche und unlösliche Salze. Der Hauptunterschied zwischen löslichen und unlöslichen Salzen besteht darin, dass lösliche Salze bei Raumtemperatur in Wasser auflösen können, während sich unlösliche Salze bei Raumtemperatur nicht in Wasser auflösen können. Darüber hinaus sind lösliche Salze polar; Deshalb können sie sich in Wasser auflösen, was ein polares Lösungsmittel ist. Im Gegensatz dazu sind unlösliche Salze unpolar.
Referenz:
1. „Unlösliche Salze.”Chemistry Libretexten, Libretexte, 5. Juni 2019, hier erhältlich.
2. „Definition von unlöslichen Salzen (Ausfälle).”Cehmicool Dictionary, hier erhältlich.
3. „Unlösliche Salze.SALTS-TRIPOD, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Natriumchlorid" von Chemicalinterest - eigene Arbeit (Public Domain) über Commons Wikimedia
2. "Silver Chlorid (AGCL)" von Luisbrudna - eigene Arbeit (CC BY -SA 4.0) über Commons Wikimedia


