Unterschied zwischen Solvationsenergie und Gitterenergie
Schlüsselunterschied - Solvationsenergie vs Gitterenergie
Solvationsenergie ist die Veränderung der Gibbs -Energie eines Lösungsmittels, wenn ein gelöster Stoff in diesem Lösungsmittel aufgelöst wird. Gitterenergie ist entweder die Energiemenge, die während der Bildung eines Gitters von Ionen freigesetzt wird, oder die Energiemenge. Der Schlüsselunterschied Zwischen Solvationsenergie und Gitterenergie ist das Solvationsenergie ergibt die Enthalpieänderung beim Auflösen eines gelösten gelösten Lösungsmittel.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Solvationsenergie
3. Was ist Gitterenergie
4. Seite an Seite Vergleich - Solvationsenergie gegen Gitterenergie in tabellarischer Form
5. Zusammenfassung
Was ist Solvationsenergie?
Solvationsenergie ist die Änderung der Gibbs -Energie, wenn ein Ion oder ein Molekül von einem Vakuum (oder der Gasphase) auf ein Lösungsmittel übertragen wird. Solvation ist die Wechselwirkung zwischen Lösungsmittel und Molekülen oder Ionen eines gelösten Stoffes. Der gelöste gelöste ist die Verbindung, die im Lösungsmittel gelöst wird. Einige gelöste gelöste bestehen aus Molekülen, während einige Ionen enthalten.
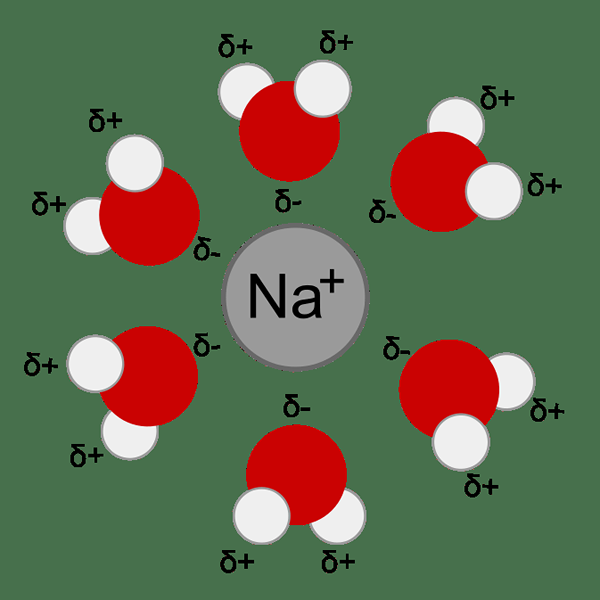
Die Wechselwirkung zwischen Lösungsmittel- und gelösten Partikeln bestimmen viele der Eigenschaften eines gelösten Stoffes. Beispiel: Löslichkeit, Reaktivität, Farbe usw. Während des Solvatationsprozesses werden gelöste Partikel von Lösungsmittelmolekülen umgeben, die Solvatationskomplexe bilden. Wenn das an dieser Solvation beteiligte Lösungsmittel Wasser ist, wird der Prozess als Hydratation bezeichnet.
Während des Solvationsprozesses werden verschiedene Arten von chemischen Bindungen und Wechselwirkungen gebildet. Wasserstoffbrückenbindungen, Ionen-Dipol-Wechselwirkungen und Van der Waal-Kräfte. Komplementäre Eigenschaften von Lösungsmittel und gelösten Stoff bestimmen die Löslichkeit eines gelösten Stoffes in einem Lösungsmittel. Zum Beispiel ist die Polarität ein Hauptfaktor, der die Löslichkeit eines gelösten Stoffes in einem Lösungsmittel bestimmt. Polare gelöste Stoffe lösten sich in polaren Lösungsmitteln gut auf. Nichtpolare gelöste Stoffe lösten sich in nichtpolaren Lösungsmitteln gut auf. Die Löslichkeit von polaren Stoffen in nichtpolaren Lösungsmitteln (und umgekehrt) ist jedoch schlecht.

Abbildung 01: Solvation eines Natriumkation im Wasser
Wenn es um die Thermodynamik geht, ist die Solvatation nur dann möglich (spontan), wenn die Gibbs -Energie der endgültigen Lösung niedriger ist als die einzelnen Gibbs -Energien von Lösungsmittel und gelösten Stoff. Daher sollte die freie Energie von Gibbs ein negativer Wert sein (die freie Energie des Systems sollte nach der Bildung der Lösung verringert werden). Die Solvation enthält verschiedene Schritte mit unterschiedlichen Energien.
- Bildung eines Lösungshöhle, um Platz für gelöste Stoffe zu schaffen. Dies ist thermodynamisch ungünstig, da die Wechselwirkungen zwischen dem Lösungsmittelmolekül verringert und die Entropie verringert wird.
- Die Trennung des Stoffteilchens von der Masse ist ebenfalls thermodynamisch ungünstig. Das liegt daran.
- Die lösungsmittellöslichen Wechselwirkungen finden statt, wenn der gelöste Stoff in die Lösungsmittelhöhle eintritt, thermodynamisch günstig ist.
Solvationsenergie wird auch als Enthalpie der Solvatation bezeichnet. Es ist nützlich, die Auflösung einiger Gitter in Lösungsmitteln zu erklären, während einige Gitter nicht tun. Die Veränderung der Enthalpie der Lösung ist der Unterschied zwischen Energien, einen gelösten Schüttgut zu freiszen und gelöste Stoff mit Lösungsmittel zu kombinieren. Wenn ein Ion einen negativen Wert für die Enthalpieänderung der Lösung hat, zeigt es an, dass sich das Ion in diesem Lösungsmittel eher auflöst. Ein hoher positiver Wert zeigt an, dass sich das Ion seltener auflöst.
Was ist Gitterenergie?
Gitterenergie ist ein Maß für die im Kristallgitter einer Verbindung enthalten. Die Gitterenergie einer Verbindung kann auch als die Energiemenge definiert werden, die erforderlich ist, um einen ionischen Feststoff in seine Atome in der Gasphase zu zerlegen.
Ionen Feststoffe sind sehr stabile Verbindungen aufgrund der Enthalpien der Bildung von ionischen Molekülen zusammen mit der Stabilität aufgrund der Gitterenergie der festen Struktur. Aber die Gitterenergie kann nicht experimentell gemessen werden. Daher a Born-Haber-Zyklus wird verwendet, um die Gitterenergie von ionischen Feststoffen zu bestimmen. Es müssen mehrere Begriffe verstanden werden, bevor Sie einen Born-Haber-Zyklus zeichnen.
- Ionisierungsenergie - die Energiemenge, die erforderlich ist, um ein Elektron aus einem neutralen Atom im Gas zu entfernen
- Elektronenaffinität - die Energiemenge, die freigesetzt wird, wenn ein Elektron zu einem neutralen Atom im Gas hinzugefügt wird
- Dissoziationsenergie - die Energiemenge, die erforderlich ist, um eine Verbindung in Atome oder Ionen auseinanderzumachen.
- Sublimationsenergie - die Energiemenge, die erforderlich ist, um einen Feststoff in seinen Dampf umzuwandeln
- Die Bildungswärme - die Energieänderung, wenn eine Verbindung aus ihren Elementen gebildet wird.
- Das Hess -Gesetz - ein Gesetz, das besagt.
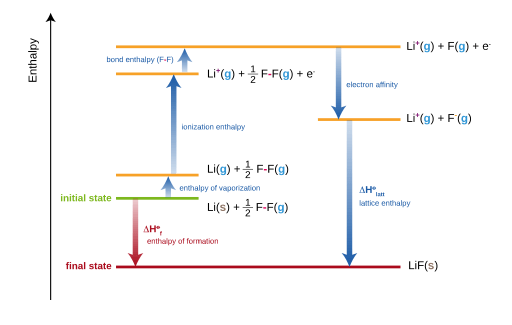
Abbildung 02: Der Born-Haber-Zyklus zur Bildung von Lithiumfluorid (LIF)
Der Born-Haber-Zyklus kann durch die folgende Gleichung gegeben werden.
Bildungswärme = Atomisierungwärme + Dissoziationsenergie + Summe von Ionisationsenergien + Summe der Elektronenaffinitäten + Gitterenergie
Dann kann die Gitterenergie einer Verbindung erhalten werden, indem diese Gleichung wie folgt neu angeordnet wird.
Gitterenergie = Bildungswärme - Zerstäubungswärme + Dissoziationsenergie + Summe von Ionisationsenergien + Summe der Elektronenaffinitäten
Was ist der Unterschied zwischen Solvationsenergie und Gitterenergie?
Solvationsenergie gegen Gitterenergie | |
| Solvationsenergie ist die Änderung der Gibbs -Energie, wenn ein Ion oder ein Molekül von einem Vakuum (oder der Gasphase) auf ein Lösungsmittel übertragen wird. | Gitterenergie ist ein Maß für die im Kristallgitter einer Verbindung enthalten. |
| Prinzip | |
| Solvationsenergie ergibt die Enthalpieänderung beim Auflösen eines gelösten Stoffes in einem Lösungsmittel. | Gitterenergie gibt die Enthalpieänderung bei Bildung (oder Abbruch) eines Gitters. |
Zusammenfassung - Solvationsenergie vs Gitterenergie
Solvationsenergie ist die Veränderung der Enthalpie eines Systems während der Solvation eines gelösten Stoffes in einem Lösungsmittel. Gitterenergie ist die Energiemenge, die während der Bildung eines Gitters freigesetzt wird, oder die Energiemenge, die erforderlich ist, um ein Gitter abzubauen. Der Unterschied zwischen Solvatationsenergie und Gitterenergie besteht darin, dass Solvationsenergie die Enthalpieänderung bei der Auflösung eines gelösten Stoffes in einem Lösungsmittel ergibt.
Referenz:
1.„Gitterenergie.”Chem.Purdue.Edu. Hier verfügbar
2.Internationale Union der reinen und angewandten Chemie. „Solvationsenergie.IUPAC Gold Book - Solvationsenergie. Hier verfügbar
3.„Solvation.Wikipedia, Wikimedia Foundation, 5. März. 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.'Na+H2O'By Taxman (Public Domain) über Commons Wikimedia
2.'Born-Haber Cycle Lif'by Jkwchui-eigene Arbeit, (CC BY-SA 3.0) über Commons Wikimedia


