Unterschied zwischen SP SP2 und SP3
Der Schlüsselunterschied Zwischen sp Sp2 und SP3 ist das die SP -Hybridorbitale haben 50% s Orbitaleigenschaften und SP2 -Hybridorbitale haben 33% s Orbitaleigenschaften, während SP3 -Hybridorbitale 25% s Orbitaleigenschaften haben.
Die Begriffe SP, SP2 und SP3 beziehen sich auf verschiedene Hybridisierungen von Orbitalen, die zu hybriden Orbitalen führen. Orbitale sind hypothetische Regionen um einen Kern eines Atoms, der Elektronen dieses Atoms enthalten. Diese Orbitale können sich einer Hybridisierung unterziehen, um neue Hybridorbitale zu bilden, die kovalente chemische Bindungen bilden können. Es gibt verschiedene Formen von Hybridisierungen gemäß den atomaren Orbitalen, die am Hybridisierungsprozess teilnehmen. SP, SP2 und SP3 sind einige häufige Hybridisierungen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist sp
3. Was ist sp2
4. Was ist SP3
5. Seite an Seite Vergleich - SP VS SP2 gegen SP3 in tabellarischer Form
6. Zusammenfassung
Was ist sp?
SP -Hybridisierung ist die einfachste Form der Hybridisierung, in der sich ein S -Orbital mit einem P -Orbital überlappt, um zwei neue SP -Orbitale zu bilden. Eine Elektronschale enthält drei P -Orbitale. In dieser Hybridisierung mischt sich einer dieser drei P -Orbitale mit einem S -Orbital desselben Atoms. Daher sind in diesen Atomen zwei nicht hybridisierte P-Orbitale übrig.

Abbildung 01: räumliche Anordnung von SP -Hybridorbitalen
Das Verhältnis der Mischung der beiden Atomorbitale beträgt 1: 1 (s: p). Daher hat das neue hybride Orbital 50% der S -Orbitaleigenschaften und 50% der P -Orbitaleigenschaften. Diese Mischung der S- und P -Atomorbitale bildet zwei neue Hybridorbitale. Diese beiden Orbitale ordnen sich in einer linearen räumlichen Anordnung an; Regie jedes atomare Orbital in die entgegengesetzten Richtungen. Diese Anordnung führt zu einer geringsten Dehnung zwischen den beiden Orbitalen. Daher beträgt der Bindungswinkel 180 °.
Was ist sp2?
SP2 -Hybridisierung ist eine Form der Orbitalhybridisierung, bei der sich ein S -Orbital mit zwei P -Orbitalen überlappt, um drei neue Hybridorbitale zu bilden. Da es drei P-Atom-Orbitale in einem Atom gibt, lässt diese Hybridisierung ein nicht hybridisiertes P-Orbital. Im Gegensatz zur SP -Hybridisierung ist in dieser Form der Hybridisierung das für jedes SP2 -Hybrid -Orbital charakteristische S 33% vorhanden, während die P -Orbitalcharakteristik 66% beträgt.
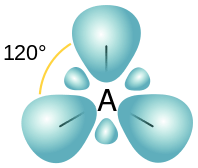
Abbildung 02: räumliche Anordnung von SP2 -Orbitalen
Dies sind jedoch nur ungefähre Werte, da das Verhältnis zwischen den drei atomaren Orbitalen an dieser Hybridisierung beträgt S: p = 1: 2.
Dann entspricht die S -Eigenschaft 100/3 = 33.33%
Und die P -Eigenschaft gleich (100/3) x 2 = 66.66%
Diese drei neuen Hybridorbitale erhalten die trigonale planare räumliche Anordnung, um die Dehnung zwischen den Orbitalen zu minimieren. Auch der Bindungswinkel zwischen diesen Orbitalen beträgt 120 °.
Was ist SP3?
SP3 -Hybridisierung ist eine Form der Orbitalhybridisierung, bei der sich ein S -Orbital mit drei P -Orbitalen überlappt. Daher gibt es keine nicht hybridisierten P-Orbitale, da alle P-Orbitale in den Hybridisierungsprozess beinhalten.

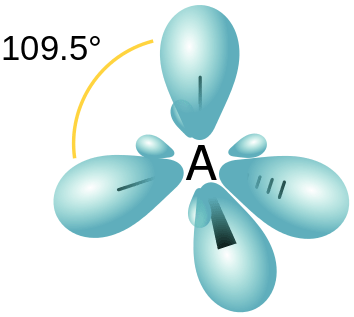
Abbildung 03: räumliche Anordnung von SP3 -Hybridorbitalen
Dies führt daher zu 4 neuen Hybridorbitalen. Da das Verhältnis zwischen S- und P -Orbitalen 1: 3 beträgt, beträgt die S -charakteristische Signalistik jedes hybriden Orbitals 25%, während die P -Orbitalcharakteristik 75% beträgt. Diese neuen Hybridorbitale ordnen sich in einer tetraedrischen Anordnung mit 109 an.5◦ Bindungswinkel.
Was ist der Unterschied zwischen SP SP2 und SP3?
SP -Hybridisierung ist die einfachste Form der Hybridisierung, bei der sich ein S -Orbital mit einem P -Orbital über zwei neue SP -Orbitale überlappt, und eine SP2 -Hybridisierung ist eine Form der Orbitalhybridisierung, bei der sich ein S -Orbital mit zwei P -Orbitalen überlappt, um drei neue Hybrid -Orbitale zu formen Während die SP3 -Hybridisierung eine Form der Orbitalhybridisierung ist, in der sich ein S -Orbital mit drei P -Orbitalen überlappt. Dies ist der grundlegende Unterschied zwischen sp2- und sp3 hybridorbitalen. Darüber hinaus hat jede der neuen Hybridorbitale, die in diesen drei Formen von Hybridisierungen bilden. Deshalb haben sie auch unterschiedliche P -Orbitaleigenschaften.
Wir können jedoch den Hauptunterschied zwischen SP SP 2 und SP3 -Hybridisierung gemäß den für diese Hybridorbitale charakteristischen S hervorheben. SP -Hybridorbitale haben 50% s Orbitaleigenschaften, und SP2 -Hybridorbitale haben 33% s Orbitaleigenschaften, während SP3 -Hybridorbitale 25% s Orbitaleigenschaften haben. Darüber hinaus hinterlässt jede Hybridisierung unterschiedliche Anzahl von nicht hybridisierten Orbitalen. Zum Beispiel beinhaltet die SP -Hybridisierung nur 1 P Atom -Orbitale. So lässt es zwei nicht hybridisierte P-Atom-Orbitale.
Die folgende Infografik zeigt einen detaillierten Vergleich nebeneinander über den Unterschied zwischen SP SP 2 und SP3 -Hybridisierung.

Zusammenfassung -SP SP2 gegen SP3
Hybridisierung ist ein Prozess, bei dem sich Atomorbitale miteinander mischen, um neue hybride Orbitale zu bilden, die sich einer kovalenten chemischen Bindung durchlaufen können. Die einfachsten Formen von Atom -Orbitalhybridisierungen sind SP-, SP2- und SP3 -Hybridisierungen. Der Schlüsselunterschied zwischen SP SP2 und SP3 besteht darin, dass die SP -Hybridorbitale 50% S Orbitaleigenschaften aufweisen und die SP2 -Hybridorbitale 33% s Orbitaleigenschaften aufweisen, während die SP3 -Hybridorbitale 25% S Orbitaleigenschaften aufweisen.
Referenz:
1. „Orbital Hybridisierung.Wikipedia, Wikimedia Foundation, 13. September. 2018. Hier verfügbar
2. Libretexten. „Hybridisierung.”Chemistry Libretexten, Libretexte, 21. Juli 2016. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.”Ae2h” von jfmelero - eigene Arbeit (CC BY -SA 3).0) über Commons Wikimedia
2.”Ae3h” von jfmelero - eigene Arbeit (CC BY -SA 3.0) über Commons Wikimedia
3.”Ae4h” von jfmelero - eigene Arbeit (CC BY -SA 3.0) über Commons Wikimedia


