Unterschied zwischen stabilen Isotopen und Radioisotopen
Schlüsselunterschied - stabile Isotope gegen Radioisotope
Isotope sind unterschiedliche Formen desselben chemischen Elements mit unterschiedlichen Atommassen. Dies bedeutet, dass Isotope eines bestimmten chemischen Elements die gleiche Atomzahl, aber unterschiedliche Atommassen haben. Dies liegt daran, dass diese Isotope unterschiedliche Anzahl von Neutronen in ihren Atomkernen haben. Einige Isotope sind stabil, während einige instabil sind. Stabile Isotope sind natürlich vorkommende Formen chemischer Elemente. Diese stabilen Isotope können natürlich in atomarer Form oder in Kombination mit anderen Atomen auftreten. Instabile Isotope unterziehen sich radioaktiv, bis sie einen stabilen Zustand erhalten. Diese Isotope sind als Radioisotope bekannt. Der wichtigste Unterschied zwischen stabilen Isotopen und Radioisotopen ist das Stabile Isotope unterziehen sich nicht radioaktiv, während Radioisotope radioaktiver Zerfall unterzogen werden.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind stabile Isotope
3. Was sind Radioisotope
4. Seite an Seitenvergleich - stabile Isotope gegen Radioisotope in tabellarischer Form
5. Zusammenfassung
Was sind stabile Isotope?
Stabile Isotope sind unterschiedliche Formen desselben chemischen Elements mit stabilen Kernen. Diese Atome haben die gleiche Atomzahl (Anzahl der Protonen in den Atomkern), weil sie zu demselben chemischen Element gehören, aber die Atommassen unterscheiden sich voneinander, weil sie unterschiedliche Anzahl von Neutronen in den Atomkern haben.
Stabile Isotope sind aufgrund der Stabilität der Atomkerne nicht radioaktiv. Daher emittieren diese Atome keine Strahlung. Ein bestimmtes chemisches Element kann mehr als ein stabiles Isotop haben. In einigen chemischen Elementen sind jedoch alle Isotope instabil; Daher sind sie radioaktiv.

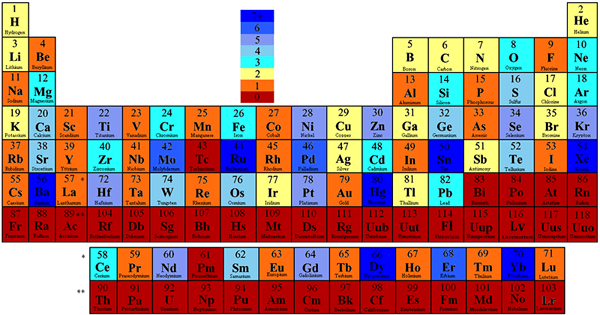
Abbildung 1: Periodische Tabelle farbig basierend auf der Anzahl stabiler Isotope
Die Stabilität von Atomkern hängt von zwei grundlegenden Faktoren ab:
- Verhältnis zwischen Protonen und Neutronen
- Summe von Protonen und Neutronen
"Magic Nummern" ist ein chemisches Konzept, das verwendet wird, um die Stabilität eines bestimmten Atomkerns zu bestimmen. Es gibt die Anzahl der in stabilen Isotopen vorhandenen Elektronen. Die magische Zahl kann entweder die Anzahl der Protonen oder sogar die Anzahl der im Kern vorhandenen Neutronen sein.
Magische Zahlen: 2, 8, 20, 28, 50, 82 und 126
Wenn die Atomzahl eines Isotops einer der obigen Zahlen entspricht, dann ist es ein stabiles Isotop. Wenn ein Isotop 114 Protonen hat, ist es außerdem ein stabiles Isotop. Wenn es 126 oder 184 Neutronen gibt, sind sie außerdem stabile Isotope. Wenn die Verhältnisse zwischen Protonen und Neutronen in einem Atom sogar Zahlen sind, sind diese Isotope höchstwahrscheinlich stabile Isotope.
Was sind Radioisotope?
Radioisotope sind instabile Isotope chemischer Elemente, die sich radioaktiver Zerfall unterziehen. Diese Isotope werden radioaktiver Zerfall unterzogen, da sie instabile Atomkerne haben. Die meisten chemischen Elemente haben ein oder mehrere radioaktive Isotope, während einige chemische Elemente nur radioaktive Isotope haben (z. B. Uran).
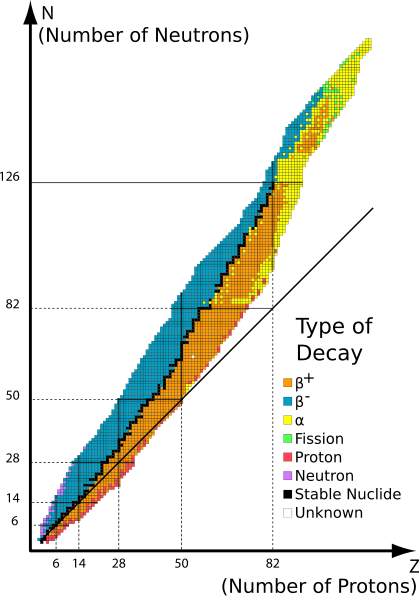
Abbildung 2: Verschiedene Radioisotope und deren radioaktiver Verfall
Radioaktive Isotope sind aus mehreren Gründen instabil:
- Vorhandensein einer hohen Anzahl von Neutronen im Atomkern im Vergleich zur Anzahl der Protonen
- In diesen Radioisotopen werden Neutronen während des radioaktiven Zerfalls in Protonen und Elektronen umgewandelt.
- Vorhandensein einer hohen Anzahl von Protonen im Atomkern
- In diesen Radioisotopen werden Protonen in Neutronen und Positronen umgewandelt.
- Vorhandensein einer hohen Anzahl von Protonen und Elektronen
- Diese Radioisotope werden Alpha -Zerfall unterzogen, bei denen zwei Protonen und zwei Neutronen als Alpha -Partikel emittiert werden
Was ist der Unterschied zwischen stabilen Isotopen und Radioisotopen?
Stabile Isotope gegen Radioisotope | |
| Stabile Isotope sind unterschiedliche Formen desselben chemischen Elements mit stabilen Kernen. | Radioisotope sind instabile Isotope chemischer Elemente, die sich radioaktiver Zerfall unterziehen. |
| Stabilität | |
| Stabile Isotope sind sehr stabil und unterziehen sich keinen radioaktiven Zerfall. | Radioisotope sind sehr instabil und unterziehen sich radioaktiv, um einen stabilen Zustand zu erhalten. |
| Protonen | |
| Das Vorhandensein von 114 Protonen macht ein Isotop zu einem stabilen Isotop. | Das Vorhandensein einer hohen Anzahl von Protonen macht ein Isotop zum Radioisotop. |
| Neutronen | |
| Das Vorhandensein von 126 oder 184 Neutronen macht ein Isotop zu einem stabilen Isotop. | Die Anzahl der Neutronen im Atomradius ist höher als die Anzahl der Protonen. |
Zusammenfassung -stabile Isotope gegen Radioisotope
Isotope sind Atome des gleichen chemischen Elements mit identischen Atomzahlen, aber unterschiedlichen Atommassen. Einige Isotope sind stabil, während andere instabil sind. Stabile Isotope sind die natürlich vorkommenden Formen dieser chemischen Elemente. Instabile Isotope werden auch als Radioisotope bezeichnet. Der Hauptunterschied zwischen stabilen Isotopen und Radioisotopen basiert auf ihrer Fähigkeit, radioaktivem Zerfall zu unterziehen.
Referenz:
1. „Stabiles Isotopenverhältnis.”Wikipedia, Wikimedia Foundation, 27. Februar. 2018, hier erhältlich.
2. „Was sind Radioisotope?”Foro Nuclear, hier erhältlich.
3. Britannica, die Herausgeber von Encyclopaedia. "Magische Zahl.”Encyclopædia Britannica, Encyclopædia Britannica, Inc., 12. Juli 2017, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Periodenzüchter nach Anzahl stabiler Isotope" von Nergaal bei englischer Wikipedia (CC BY-SA 3.0) über Commons Wikimedia
2. "Tabellenisotope en" nach Table_isotopes.SVG: napy1Kenobiderivat.SVG (CC BY-SA 3.0) über Commons Wikimedia


