Unterschied zwischen starkem Liganden und schwachem Ligand
Schlüsselunterschied - starker Ligand vs Schwacher Ligand
Ein Ligand ist ein Atom, ein Ion oder ein Molekül. Das Konzept der Liganden wird unter Koordinationschemie erörtert. Liganden sind chemische Arten, die an der Bildung von Komplexen mit Metallionen beteiligt sind. Daher sind sie auch als Komplexagenten bekannt. Liganden können monodentat, zweizähnig, dreißig usw. sein. Basierend auf der Dentizität des Liganden. Dentizität ist die Anzahl der in einem Ligand vorhandenen Spendergruppen. Monodentat bedeutet, dass Ligand nur eine Spendergruppe hat. Bucker bedeutet, dass es zwei Spendergruppen pro Ligandenmolekül hat. Es gibt zwei Haupttypen von Liganden, die auf der Basis der Kristallfeldtheorie kategorisiert sind. Starke Liganden (oder starke Feldliganden) und schwache Liganden (oder schwache Feldliganden). Der Schlüsselunterschied Zwischen starken Liganden und schwachen Liganden ist das Die Aufteilung von Orbitalen nach der Bindung an einen starken Feldliganden führt zu einem höheren Unterschied zwischen den Orbitalen mit höherem und niedrigerem Energieniveau, während die Aufteilung von Orbitalen nach der Bindung an einen schwachen Feldliganden eine geringere Differenz zwischen den höheren und niedrigeren Energiehorbusalen verursacht.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist die Kristallfeldtheorie
3. Was ist starker Ligand
4. Was ist schwacher Ligand
5. Nebenseitiger Vergleich - starker Ligand gegen schwache Ligand in tabellarischer Form
6. Zusammenfassung
Was ist die Kristallfeldtheorie?
Die Kristalle -Feldtheorie kann als Modell beschrieben werden, das das Brechen von Degenerität (Elektronenschalen gleicher Energie) von Elektronenorbitalen (normalerweise D oder F -Orbitale) aufgrund des statischen elektrischen Feldes erklärt Liganden). Diese Theorie wird häufig verwendet, um das Verhalten von Übergangsmetallionenkomplexen zu demonstrieren. Diese Theorie kann die magnetischen Eigenschaften, Farbkomplexe, Hydratationenthalpien usw. erklären.
Theorie:
Die Wechselwirkung zwischen Metallion und Liganden ist ein Ergebnis der Anziehungskraft zwischen dem Metallion mit einer positiven Ladung und der negativen Ladung der ungepaarten Elektronen des Liganden. Diese Theorie basiert hauptsächlich auf den Änderungen in fünf degenerierten Elektronenorbitalen (ein Metallatom hat fünf D -Orbitale). Wenn ein Ligand dem Metallion nahe kommt. Dies verursacht einen Verlust der Entartung. Und auch die Elektronen in den D -Orbitalen wehren die Elektronen des Liganden ab (weil beide negativ geladen sind). Daher haben die D -Orbitale, die näher am Liganden liegen. Dies führt zur Aufteilung von D -Orbitalen in Hochergie -D -Orbitale und niedrige Energie -D -Orbitale, basierend auf der Energie.
Einige Faktoren, die diese Aufteilung beeinflussen, sind; Art des Metallions, des Oxidationszustands des Metallions, der Anordnung von Liganden rund um das zentrale Metallion und die Natur von Liganden. Nach der Aufteilung dieser D-Orbitale basierend auf Energie wird die Differenz zwischen den Orbitalen mit hoher und niedriger Energie D als Kristallfeldspaltungsparameter bezeichnet (∆Oktober für oktaedrische Komplexe).

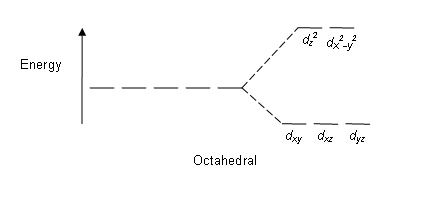
Abbildung 01: Spaltmuster in oktaedrischen Komplexen
Spaltmuster: Da es fünf D -Orbitale gibt, tritt die Aufteilung in einem Verhältnis von 2: 3 auf. In oktaedrischen Komplexen befinden sich zwei Orbitale in der hohen Energieniveau (kollektiv als 'bekannt'z.B') und drei Orbitale befinden sich in der niedrigeren Energieniveau (kollektiv als bekannt als t2g). In tetraedrischen Komplexen tritt das Gegenteil auf; Drei Orbitale befinden sich im höheren Energieniveau und zwei im niedrigeren Energieniveau.
Was ist starker Ligand?
Ein starker Ligand oder ein starker Feldligand ist ein Ligand, der zu einer höheren Kristallfeldaufteilung führen kann. Dies bedeutet, dass die Bindung eines starken Feldliganden einen höheren Unterschied zwischen den Orbitalen höherer und niedrigerer Energieniveaus verursacht. Beispiele sind CN- (Cyanidliganden), nein2- (Nitro -Ligand) und CO (Carbonylliganden).
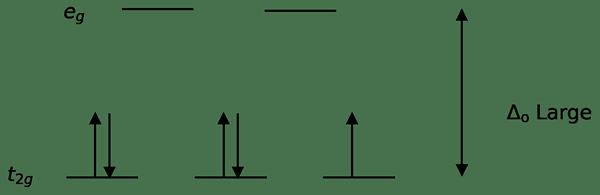
Abbildung 02: niedrige Spinspaltung
Bei der Bildung von Komplexen mit diesen Liganden werden zunächst die niedrigeren Energieorbitale (T2G) vollständig mit Elektronen gefüllt, bevor sie an anderen Orbitalen mit hohem Energieniveau füllen (z. B.). Die auf diese Weise gebildeten Komplexe werden als „niedrige Spinkomplexe“ bezeichnet.
Was ist schwacher Ligand?
Ein schwacher Ligand oder ein schwacher Feldligand ist ein Ligand, der zu einer niedrigeren Kristallfeldaufteilung führen kann. Dies bedeutet, dass die Bindung eines schwachen Feldligand.
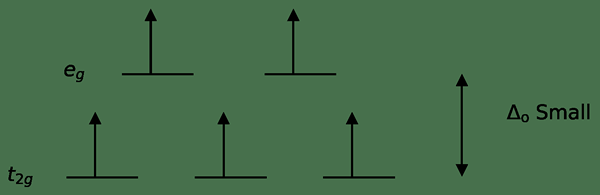
Abbildung 3: Hohe Spinspaltung
In diesem Fall können die höheren Energieorbitale im Vergleich zu den Orbitalen mit niedriger Energie leicht mit Elektronen gefüllt werden. Die mit diesen Liganden gebildeten Komplexe werden als „hohe Spinkomplexe“ bezeichnet. Beispiele für schwache Feldliganden sind i- (Iodid Ligand), Br- (Bromidligand) usw.
Was ist der Unterschied zwischen starkem Liganden und schwachem Ligand?
Starker Ligand gegen schwache Ligand | |
| Ein starker Ligand oder ein starker Feldligand ist ein Ligand, der zu einer höheren Kristallfeldaufteilung führen kann. | Ein schwacher Ligand oder ein schwacher Feldligand ist ein Ligand, der zu einer niedrigeren Kristallfeldaufteilung führen kann. |
| Theorie | |
| Die Aufteilung nach der Bindung eines starken Feldliganden führt zu einem höheren Unterschied zwischen den Orbitalen höherer und niedrigerer Energiespiegel. | Die Aufteilung von Orbitalen nach der Bindung eines schwachen Feldligand. |
| Kategorie | |
| Die mit starken Feldliganden gebildeten Komplexe werden als „niedrige Spinkomplexe“ bezeichnet. | Die mit schwachen Feldliganden gebildeten Komplexen werden als „hohe Spinkomplexe“ bezeichnet. |
Zusammenfassung - Starker Ligand vs Schwacher Ligand
Starke Liganden und schwache Liganden sind Anionen oder Moleküle, die die Aufteilung von D -Orbitalen eines Metallionen in zwei Energieniveaus verursachen. Der Unterschied zwischen starken Liganden und schwachen Liganden besteht darin, dass die Aufteilung nach der Bindung eines starken Feldliganden einen höheren Unterschied zwischen den Orbitalen mit höherem und niedrigerem Energieniveau verursacht, während die Aufteilung von Orbitalen nach der Bindung eines schwachen Feldliganden einen geringeren Unterschied zwischen dem höheren und niedrigeren verursacht Energieniveau Orbitale.
Referenz:
1.Helmenstine, Anne Marie, D. „Ligand -Definition.”Thoughtco, Februar. 11, 2017. Hier verfügbar
2.„Liganden.Chemie -Libretexte, Libretexten, 19. Januar. 2018. Hier verfügbar
3.Die Herausgeber von Encyclopædia Britannica. „Ligand.”Encyclopædia Britannica, Encyclopædia Britannica, Inc., 12. August. 2010. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.'Oktaedrisch Kristallfeld Spliting' von englischer Wikipedia-Benutzer Yana (CC BY-SA 3).0) über Commons Wikimedia
2.'CFT-Low Spin Spled Diagramm-Vektor'by offnfopt, (öffentliches Domäne) über Commons Wikimedia
3.'CFT-High-Spin-Split-Diagramm-Vektor'by offnfopt, Referenzbild, das von Yana-eigene Arbeit (gemeinfrei) über Commons Wikimedia erstellt wurde


