Unterschied zwischen transuranischen Elementen und Radioisotopen
Der Schlüsselunterschied Zwischen transuranischen Elementen und Radioisotopen ist das Transuranische Elemente sind die chemischen Elemente mit Atomzahlen von mehr als 92, während Radioisotope instabile Atome sind, die radioaktiv sind.
Sowohl transuranische Elemente als auch Radioisotope sind radioaktive chemische Elemente. In den meisten Fällen haben radioaktive Atome eine hohe Atomzahl, aber manchmal kann es seltene Isotope einiger chemischer Elemente mit einer kleinen Atomzahl geben.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind transuranische Elemente
3. Was sind Radioisotope
4. Seite an Seitenvergleich - Transuranische Elemente gegen Radioisotope in tabellarischer Form
5. Zusammenfassung
Was sind transuranische Elemente?
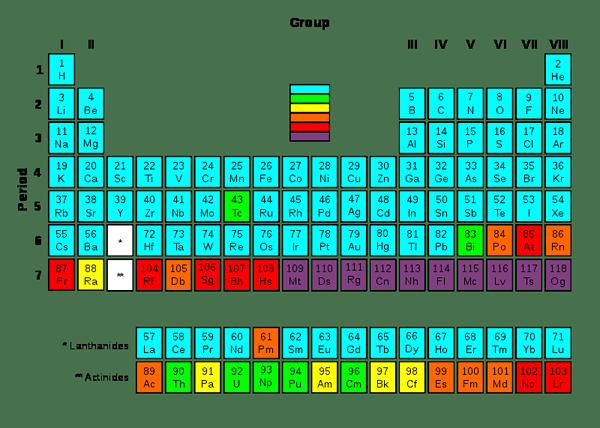
Transuranische Elemente oder Transuranelemente sind chemische Elemente mit Atomzahlen höher als 92. Die Atomzahl von Uran beträgt 92; Daher beginnt die Reihe der transuranischen Elemente mit Uranium, was den Namen dieser Serie leitet (Trans + Uranium). Alle Mitglieder dieser Liste sind aufgrund ihrer instabilen Natur radioaktiv.
Die meisten chemischen Elemente in der Periodenzüchter haben Isotope, die wir im Universum entweder als stabile Atome oder als chemische Elemente mit einer sehr langen Halbwertszeit finden können. Diese chemischen Elemente liegen im Bereich von 1 bis 92 Atomzahlen.

Abbildung 01: transuranische Elemente
Wir können transuranische Elemente erzeugen, indem wir synthetische Elemente verwenden, Kernreaktoren verwenden oder Partikelbeschleuniger verwenden. Es besteht eine Beziehung zwischen der Atomzahl und der Halbwertszeit dieser Elemente. Die Halbwertszeiten nehmen im Allgemeinen mit zunehmender Atomzahlen ab. Es kann jedoch einige Ausnahmen aufgrund einiger Isotope geben. Zum Beispiel Isotope von Curium und Dubnium.
Liste der transuranischen Elemente
- Actinides
- Neptunium
- Plutonium
- Amerika
- Kurium
- Berkelium
- Kalifornien
- Einsteinium
- Fermium
- Mendelevium
- Nobel
- Lawrencium
- Transaktinidelemente
- Rutherfordium
- Dubnium
- Seeborgium
- Bohrium
- Hsium
- Meitnerium
- Darmstadt
- Roentgenium
- Copernicium
- Nihonium
- Ferrovium
- Moscovium
- Lebermorium
- Tennessine
- Oganesson
- Elemente in Periode 8 (noch nicht entdeckt)
Was sind Radioisotope?
Radioisotope sind radioaktive Isotope chemischer Elemente. Diese Isotope sind instabil, weil sie überschüssige Kernenergie haben. Es gibt drei Möglichkeiten, wie ein Radioisotop diese Kernenergie freigibt:
- Als Gammastrahlung
- Veröffentlichung eines Umwandlungselektrons
- Alpha- oder Beta -Partikelemission
Wenn eine der oben genannten drei Aktionen auftritt, ist der radioaktive Verfall stattgefunden. Wir nennen diese Emissionen als ionisierende Strahlung, weil diese emittierten Strahlen ein anderes Atom ionisieren können, um ein Elektron zu befreien.

Abbildung 02: Americium ist ein Radioisotop
Alle chemischen Elemente können als radioaktive Atome in ihren isotopischen Formen existieren. Zum Beispiel hat auch der leichteste Element -Wasserstoff ein radioaktives Isotop - Tritium. Darüber hinaus existieren einige chemische Elemente nur als radioaktive Elemente.
Was ist der Unterschied zwischen transuranischen Elementen und Radioisotopen?
Sowohl transuranische Elemente als auch Radioisotope sind radioaktive chemische Elemente. Der wichtigste Unterschied zwischen transuranischen Elementen und Radioisotopen besteht darin, dass die transuranischen Elemente die chemischen Elemente mit Atomzahlen von mehr als 92 sind, während die Radioisotope instabile Atome sind, die radioaktiv sind.
Darüber hinaus existieren die transuranischen Elemente nur als radioaktive Atome, während die Radioisotope Isotope chemischer Elemente sind, die als radioaktive Atome existieren. Zum Beispiel sind Aktinidreihen, Transaktinidreihen und Elemente von Periode 8 transuranische Elemente. Tritiumisotop von Wasserstoff ist ein sehr leichtes Radioisotop mit einer sehr niedrigen Atomzahl.
Die folgende Infografik fasst den Unterschied zwischen transuranischen Elementen und Radioisotopen zusammen.

Zusammenfassung -transuranische Elemente gegen Radioisotope
Sowohl transuranische Elemente als auch Radioisotope sind radioaktive chemische Elemente. Der wichtigste Unterschied zwischen transuranischen Elementen und Radioisotopen besteht darin, dass die transuranischen Elemente die chemischen Elemente mit Atomzahlen von mehr als 92 sind, während die Radioisotope instabile Atome sind, die radioaktiv sind.
Referenz:
1. Fry, Brian. „Verwenden Sie stabile Isotopen -Tracer.Stabile Isotopenökologie, 2006, pp. 40-75., doi: 10.1007/0-387-33745-8_3.
2. „Radioisotope.IAEO, IAEO, 15. Juli 2016, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Periodenkabine Radioaktivität" nach periodic_table_armtuk3.SVG: Armtuk (Diskussion) Derivatarbeit: Alessio Rolleri (Diskussion) Derivatarbeit: Gringer (Diskussion) - Periodic_Table_armTuk3.SVG (CC BY-SA 3.0) über Commons Wikimedia
2. "Americium-241 Probe vom Rauchdetektor" durch MedicalReference-Selbstfotografiert (CC BY-SA 3.0) über Commons Wikimedia