Unterschied zwischen Ubiquitinierung und Sumylierung
Der Schlüsselunterschied Zwischen Ubiquitinierung und Sumylierung ist das Ubiquitinierung ist eine posttranslationale Modifikation, die Proteine für den Abbau markieren oder andere Singlingfunktionen aufweisen kann, während Sumoylierung eine posttranslationale Modifikation ist, die in Zellen nicht zum Markieren von Proteinen für den Abbau verwendet wird.
Posttranslationale Modifikationen sind kovalente und enzymatische Modifikationen, die nach der Proteinsynthese auftreten. Diese Modifikationen regulieren die Proteinaktivitäten. Bindung kleiner chemischer Gruppen, Zucker, Lipide und Polypeptide modifizieren Proteine. Ubiquitin ist der bekannteste Polypeptidmodifikator. Darüber hinaus gibt es mehrere Ubiquitin-ähnliche Proteine. Der kleine Ubiquitin-verwandte Modifikator (SUMO) ist ein solcher Modifikator. Ubiquitinierung und Sumoylierung sind daher zwei posttranslationale Modifikationen. Ubiquitinierung markiert Proteine zum Abbau. Im Gegensatz dazu wird die Sumoylierung nicht verwendet, um Proteine zum Abbau zu markieren. Beide Modifikationen regulieren die Proteinlokalisierung und Aktivität. Sie sind reversible Prozesse.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Ubiquitinierung
3. Was ist Sumoylierung
4. Ähnlichkeiten zwischen Ubiquitinierung und Sumylierung
5. Seite an Seitenvergleich - Ubiquitinierung gegen Sumoylierung in tabellarischer Form
6. Zusammenfassung
Was ist Ubiquitinierung?
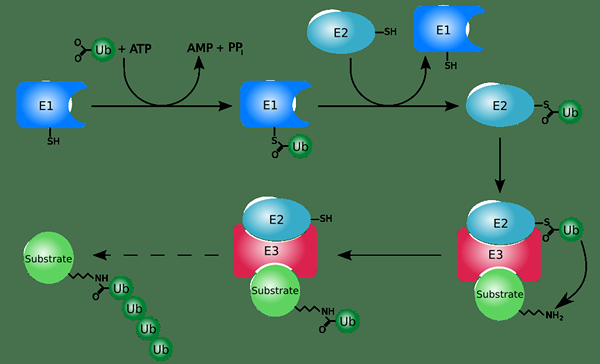
Ubiquitin ist ein Polypeptidmodifikator. Es ist ein kleines Protein, das als molekulares Tag in der posttranslationalen Modifikation von Proteinen fungiert. Ubiquitinierung ist der Prozess, der Ubiquitin für die posttranslationale Änderung verwendet. Verschiedene Enzyme katalysieren die kovalente Konjugation von Ubiquitin an Proteine. Es findet in Gegenwart von ATP statt. Die Enzyme, die Ubiquitinierung katalysieren.

Abbildung 01: Ubiquitinierung
Ubiquitinierung spielt eine wichtige Rolle bei der Ausrichtung auf Proteine für den proteolytischen Abbau. Darüber hinaus kann die Ubiquitinierung auch die Proteinlokalisierung und Aktivität regulieren. Dieser Prozess kann durch die Wirkung von Deubiquitinase -Enzymen umgekehrt werden.
Was ist Sumoylierung?
Sumoylierung ist eine weitere posttranslationale Modifikation mit kleinen Ubiquitin-ähnlichen Modifikatoren (SUMOS). Die kovalente Bindung von Sumos verändert die Struktur und Funktion des Proteins. Sumoylierung modifiziert kovalent eine große Anzahl von Proteinen, die an vielen zellulären Prozessen beteiligt sind, einschließlich der Genexpression, der Chromatinstruktur, der Signaltransduktion und der Aufrechterhaltung des Genoms.
Abbildung 02: Sumo -Protein
Die Sumoylierung reguliert die Proteinlokalisierung und -aktivität ähnlich wie die Ubiquitinierung. Im Gegensatz zur Ubiquitinierung markiert oder markiert die Sumoylierung keine Proteine zum Abbau. Ähnlich wie bei Ubiquitinierung ist die Sumoylierung ein enzymatischer Prozess, der durch Enzyme katalysiert wird.
Was sind die Ähnlichkeiten zwischen Ubiquitinierung und Sumylierung?
- Ubiquitinierung und Sumoylierung sind zwei wichtige posttranslationale Modifikationen.
- Sowohl Sumoylierung als auch Ubiquitinierung sind reversible Prozesse.
- Sie spielen eine entscheidende Rolle bei biologischen Funktionen.
- Einige Proteine können durch Sumo und Ubiquitin modifiziert werden.
- Beide Prozesse verändern die Proteinfunktion.
- Darüber hinaus regulieren beide posttranslationalen Modifikationen die Proteinlokalisierung und Aktivität.
- Sie benötigen eine Kaskade von Enzymen.
Was ist der Unterschied zwischen Ubiquitinierung und Sumylierung?
Ubiquitinierung und Sumoylierung sind zwei posttranslationale Modifikationen, die die Funktion von Proteinen verändern. Ubiquitinierung ist die kovalente Konjugation von Ubiquitin an Proteine, während die Sumoylierung die Zugabe von Sumos zu Proteinen ist. Darüber hinaus sind Ubiquitinierungs -Tags Proteine zum proteolytischen Abbau, während die Sumoylierung keine Proteine für den Abbau markiert. Dies ist daher der Schlüsselunterschied zwischen Ubiquitinierung und Sumylierung.
Die folgende Infografik zeigt mehr Details über den Unterschied zwischen Ubiquitinierung und Sumylierung.
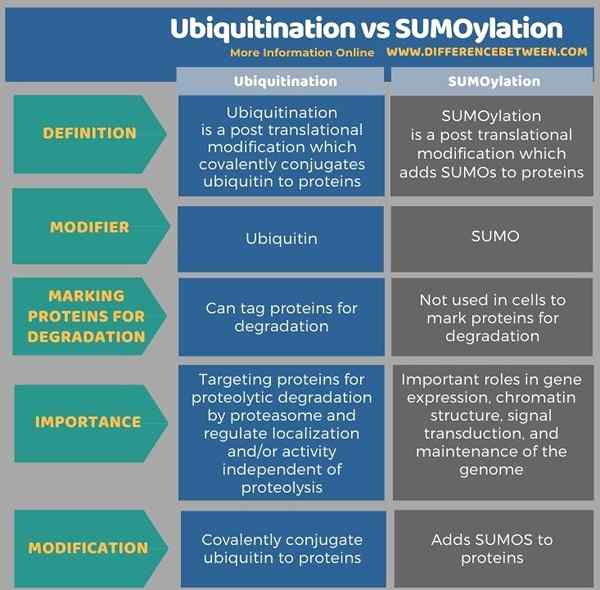
Zusammenfassung -Ubiquitinierung gegen Sumoylierung
Ubiquitinierung und Sumoylierung sind zwei wichtige posttranslationale Modifikationen. Beide sind reversible Prozesse, die durch Enzyme katalysiert werden. Bei Ubiquitinierung ist Ubiquitin der Polypeptidmodifikator, während in der Sumoylierung Sumos die Modifikatoren sind. Ubiquitine werden kovalent mit Proteinen konjugiert und verändern ihre Struktur und Funktion. Sumos werden zu Proteinen in der Sumoylierung hinzugefügt. Die Sumoylierung ist der Ubiquitylierung in Bezug auf das verwendete Reaktionsschema und die Enzymklassen analog. Ubiquitinierungs-Tags Proteine für proteasomabhängigen Abbau, während die Sumoylierung nicht an der Markierung von Proteinen für den Abbau beinhaltet. Dies ist daher der Schlüsselunterschied zwischen Ubiquitinierung und Sumylierung.
Referenz:
1. Gill, Gnade. „Sumo und Ubiquitin im Kern: verschiedene Funktionen, ähnliche Mechanismen?Gene & Entwicklung, Cold Spring Harbor Lab, 1. Januar. 1970, hier erhältlich.
2. Smith, Yolanda. „Ubiquitinierung (Ubiquitylation).”Nachrichten, 23. August. 2018, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Ubiquitylation" von Rogerdodd (CC BY-SA 3.0) über Commons Wikimedia
2. "Hsumo1 1A5R NMR -Bänder" von Jakob Suckale in English Wikipedia - ursprünglich aus en.Wikipedia (Public Domain) über Commons Wikimedia


