Unterschied zwischen universeller Gaskonstante und charakteristischer Gaskonstante
Schlüsselunterschied - Universalgaskonstante gegenüber charakteristischen Gaskonstante
Die Gasphase ist eine der drei Hauptphasen, die Materie existieren können. Es ist der komprimierbarste Zustand der drei Materiezustände. Es gibt nur 11 Elemente aus anderen Elementen als Gase unter normalen Bedingungen. Das „ideale Gasgesetz“ gibt uns jedoch eine Gleichung, die verwendet werden kann, um das Verhalten eines normalen Gases zu erklären. Es hat eine Verhältnismäßigkeitskonstante, die als Universalgaskonstante bezeichnet wird, und wenn es auf ein reales Gas angewendet wird, wird diese Konstante mit einer Modifikation verwendet. Dann wird es als charakteristische Gaskonstante bezeichnet. Der Schlüsselunterschied zwischen universeller Gaskonstante und charakteristischer Gaskonstante ist das Die universelle Gaskonstante gilt nur für ideale Gase wohingegen Charakteristische Gaskonstante gilt für reale Gase.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist universelle Gaskonstante
3. Was ist charakteristische Gaskonstante
4. Seite für Seitenvergleich - universelle Gaskonstante gegen charakteristische Gaskonstante in tabellarischer Form
5. Zusammenfassung
Was ist universelle Gaskonstante?
Gasmoleküle können im gesamten Raum frei bewegt werden, da sie sehr leichte Moleküle sind. Kräfte zwischen Gasmolekülen sind schwache Van der Waal -Anziehungskräfte. Um das Verhalten eines Gases zu erklären, haben Wissenschaftler Theorien mit einem hypothetischen Gas abgeleitet, das als ideales Gas bekannt ist. Sie haben auch ein Gesetz über dieses ideale Gas abgeleitet, das als ideales Gasgesetz bekannt ist.
Erstens sollten wir wissen, was ein ideales Gas bedeutet. Es ist ein hypothetisches Gas, das die folgenden Eigenschaften zeigen würde, wenn es ein echtes Gas wäre. Dies sind nur Annahmen.
- Ein ideales Gas besteht aus einer großen Anzahl kleiner Gasmoleküle.
- Das Volumen dieser Gasmoleküle ist vernachlässigbar.
- Es gibt keine Attraktionen zwischen Gasmolekülen.
- Die Bewegung dieser Gasmoleküle gehorcht dem Newtons Bewegungsgesetz.
- Kollisionen von Molekülen sind völlig elastisch.
Durch die Betrachtung dieser Eigenschaften ist es verständlich, dass keine der realen Gase ideal ist.
Was ist ideales Gasgesetz
Das ideale Gasgesetz zeigt den Zustand eines idealen Gases an und wird durch eine Gleichung wie folgt erklärt.
Pv = nrt
P - Druck des idealen Gases
V - Volumen des idealen Gases
n - Anzahl der Mol des idealen Gases (Substanzmenge)
T - Temperatur
Der Begriff R hier ist die universelle Gaskonstante. Der Wert von R kann berechnet werden0C- und 1ATM -Druck. Dies gibt einen Wert für die universelle Gaskonstante als 0.082057 l/(k.mol)).
Was ist charakteristische Gaskonstante?
Bei der Anwendung der idealen Gasgleichung für normale Gase erfordert die obige Gleichung eine Modifikation, da sich keine der realen Gase als ideales Gas verhalten. Somit wird dort eine charakteristische Gaskonstante anstelle einer universellen Gaskonstante verwendet. Die Eigenschaften realer Gase, die sich von einem idealen Gas unterscheiden.
- Reale Gase bestehen aus unterscheidbaren großen Molekülen im Vergleich zu idealen Gasen.
- Diese Gasmoleküle tragen ein bestimmtes Volumen.
- Es gibt schwache Van der Waal -Kräfte zwischen Gasmolekülen.
- Kollisionen sind nicht vollständig elastisch.
Daher kann das ideale Gasgesetz nicht direkt auf ein echtes Gas angewendet werden. Somit erfolgt eine einfache Änderung; Die universelle Gaskonstante wird durch die Molmasse des Gases geteilt, bevor sie in die Gleichung aufgetragen wird. Es kann wie folgt gezeigt werden.
RSpezifisch = R/m
RSpezifisch - Charakteristische Gaskonstante
R - Universal Gaskonstante
M- Molmasse des Gases
Dies kann auch für eine Mischung von Gasen verwendet werden. Dann sollte die R -Konstante durch die Molmasse der Mischung von Gasen geteilt werden. Diese charakteristische Gaskonstante ist auch als die bekannt Spezifisch Gaskonstante Weil sein Wert vom Gas oder dem Gemisch von Gasen abhängt.

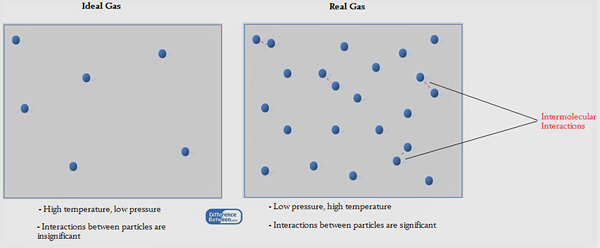
Abbildung 01: Ideales Gas gegen echtes Gas
Was ist der Unterschied zwischen universeller Gaskonstante und charakteristischer Gaskonstante?
Universalgaskonstante gegen charakteristische Gaskonstante | |
| Die universelle Gaskonstante wird nur für ein ideales Gas angewendet. | Eine charakteristische Gaskonstante wird für ein echtes Gas angewendet. |
| Berechnung | |
| Die universelle Gaskonstante wird unter Verwendung von STP -Werten (Standardtemperatur und Druck) berechnet. | Die charakteristische Gaskonstante wird mit STP -Werten zusammen mit der Molmasse des realen Gas berechnet. |
| Beziehung zum Gas | |
| Die universelle Gaskonstante ist unabhängig von dem genommenen Gas. | Die charakteristische Gaskonstante hängt vom Gas ab. |
| Wert | |
| Der Wert der universellen Gaskonstante beträgt 0.082057 l/(k.mol)). | Der Wert für eine charakteristische Gaskonstante hängt immer vom Gas ab. |
Zusammenfassung -Universalgaskonstante gegenüber charakteristischen Gaskonstante
Ein ideales Gas ist ein hypothetisches Gas, von dem angenommen wird, dass sie Eigenschaften haben, die sich sehr von einem echten Gas unterscheiden. Das ideale Gasgesetz wird gebildet, um das Verhalten eines idealen Gases zu erklären. Bei der Verwendung dieser Konstante bei realen Gasen sollte sie jedoch durch die Anwendung charakteristischer Gaskonstante als universelle Gaskonstante modifiziert werden. Das liegt daran, dass sich keine der wirklichen Gase als ideales Gas verhalten. Der Hauptunterschied zwischen der universellen Gaskonstante und der charakteristischen Gaskonstante besteht darin, dass die universelle Gaskonstante nur für ideale Gase anwendbar ist, während die charakteristische Gaskonstante für reale Gase anwendbar ist.
Laden Sie die PDF -Version der universellen Gaskonstante im Vergleich zur charakteristischen Gaskonstante herunter
Sie können die PDF -Version dieses Artikels herunterladen und ihn für Offline -Zwecke gemäß Zitatnotizen verwenden. Bitte laden Sie die PDF -Version hier den Unterschied zwischen universeller Gaskonstante und charakteristischer Gaskonstante herunter.


