Unterschied zwischen schwacher und starker Säure
Der Schlüsselunterschied Zwischen schwacher und starker Säure ist das Schwache Säuren ionisieren teilweise in Wasser, während starke Säuren vollständig ionisieren.
Die Stärke einer Säure ist seine Fähigkeit, das Wasserstoffionen in einer wässrigen Lösung zu ionisieren oder zu spenden, die mit Wasser reagiert. Je mehr ein säurer ionisiert, desto stärker ist es und desto weniger Produktion von Wasserstoffionen zeigt eine schwache Säure an. Dies ist der Unterschied zwischen einer starken und einer schwachen Säure. Die Konzentration von Ionen in einer wässrigen Lösung einer Säure sagt, wie stark oder schwach eine Säure ist. Sie können also eine konzentrierte Lösung einer schwachen Säure haben, und es ist durchaus möglich, eine verdünnte Lösung einer starken Säure zu haben.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist schwache Säure
3. Was ist starke Säure
4. Seite an Seitenvergleich - schwach gegen starke Säure in tabellarischer Form
5. Zusammenfassung
Was ist schwache Säure?
Schwache Säure bezieht sich auf die chemischen Verbindungen, die teilweise zu Ionen in einer wässrigen Lösung dissoziiert. Sie füllen nicht die Gesamtmenge an lösbarer Wasserstoffionen (H) frei+) in die Lösung. Für diese Säuren die Säure -Dissoziationskonstante oder kA ist ein kleiner Wert. Der pH dieser Lösungen liegt etwa 3 bis 5. Dies liegt vor allem daran, dass diese schwachen Säuren den Wasserstoffionengehalt in der Lösung nicht genauso erhöhen können wie eine starke Säure.

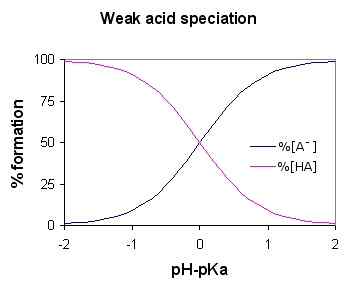
Abbildung 01: Schwaches Säurespeziationsdiagramm (für die schwache Säure HA)
Da die schwache Säure teilweise dissoziiert, enthält die wässrige Lösung drei Hauptkomponenten; Wasserstoffionen, organisierte Säuremoleküle und die konjugierte Base (an das Wasserstoffionen im Säuremolekül gebunden). Einige häufige Beispiele sind schwefelhafte Säure, Phosphorsäure, Lehrsäure usw.
Was ist starke Säure?
Starke Säure bezieht sich auf die Moleküle, die in einer wässrigen Lösung vollständig zu Ionen dissoziiert. Daher ionisieren diese Verbindungen im Wasser vollständig. Der Wert der Säure -Dissoziationskonstante oder Ka ist ein hoher Wert für diese Art von Säure. Stärker die Säure, einfacher die Freisetzung von Wasserstoffionen. Dies geschieht hauptsächlich aufgrund der hohen Polarität der H-A-Bindung, bei der H ein Wasserstoffatom ist, und A die konjugierte Basis ist. Um hoch polar zu sein, sollte der Elektronegativitätsunterschied zwischen den Atomen auf jeder Seite dieser Bindung hoch sein.
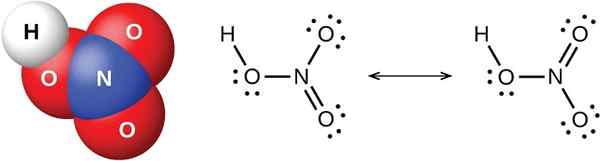
Abbildung 02: Chemische Struktur der starken Säure HNO3 (Salpetersäure)
Darüber hinaus hängt diese Wasserstoffionenfreisetzung auch von der Größe des Anion (konjugierte Basis) ab, an die das Wasserstoffionen gebunden ist. Wenn das Anion groß und stabiler ist, kann es das Wasserstoffion leicht freisetzen. Im Gegensatz zu schwachen Säuren füllen diese starken Säuren alle möglichen Wasserstoffionen auf die wässrige Lösung frei. Der pH -Wert dieser wässrigen Lösungen ist sehr klein; kann zwischen 1 und 3 liegen.
Was ist der Unterschied zwischen schwacher und starker Säure?
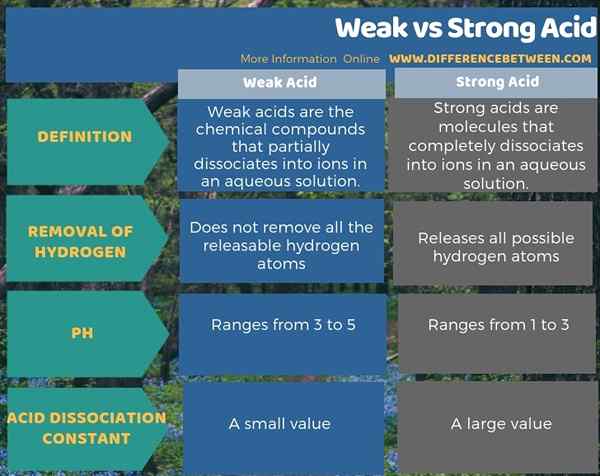
Schwache Säuren ionisieren teilweise in Wasser, während starke Säuren vollständig ionisieren. Daher ist Ionisation der Schlüsselunterschied zwischen schwacher und starker Säure. Darüber hinaus besteht ein weiterer Unterschied zwischen schwacher und starker Säure darin, dass schwache Säure nicht alle freisetzbaren Wasserstoffatome entfernen. Im Gegenteil, starke Säure freisetzt alle möglichen Wasserstoffatome.
Außerdem gibt es auch einen Unterschied zwischen schwacher und starker Säure, basierend auf ihrem pH -Wert. Das ist; Der pH -Wert von schwachen Säuren reicht von 3 bis 5, während der von starken Säuren zwischen 1 und 3 liegt. Auch die Konstante der Säuredissoziation trägt zu einem anderen Unterschied zwischen schwachem und starkem Säure bei. Säure -Dissoziationskonstante von schwacher Säure ist im Vergleich zu starken Säure gering.
Zusammenfassung -schwach gegen starke Säure
Säuren sind Moleküle, die Wasserstoffionen zu einer wässrigen Lösung freisetzen können. Wir können alle Säuren als starke Säuren, mäßig starke Säuren und schwache Säuren klassifizieren. Kurz gesagt, der Schlüsselunterschied zwischen schwacher und starker Säure besteht darin, dass schwache Säuren teilweise im Wasser ionisieren, während starke Säuren vollständig ionisieren.
Referenz:
1. Helmenstine, Anne Marie, ph.D. „Liste starker und schwacher Säuren.”Thoughtco, Sep. 24, 2018. Hier verfügbar
2. Helmenstine, Anne Marie, ph.D. „Schwache Säure -Definition und Beispiele in der Chemie.”Thoughtco, Jun. 18, 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1."Schwache Säurespeziation" von p. Gans und von Leaw übertragen., (Public Domain) über Commons Wikimedia
2.”CNX Chem 18 09 HNO3" von OpenStax (CC von 4.0) über Commons Wikimedia


