Was ist der Unterschied zwischen allosterischer Stelle und aktivem Standort
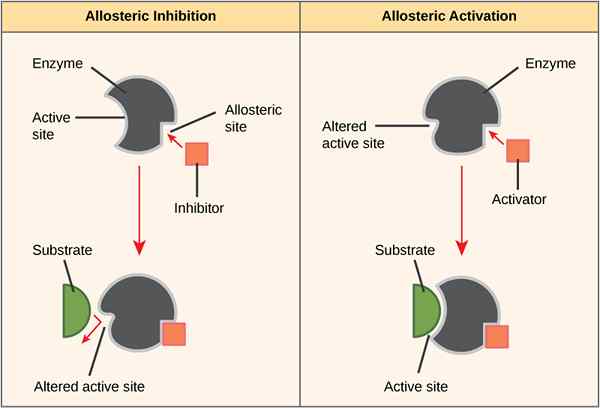
Der Schlüsselunterschied zwischen allosterischer Seite und aktivem Standort ist, dass eine allosterische Stelle eine Region eines Enzyms ist, mit dem Aktivator- oder Inhibitormoleküle an das Enzym binden und die Enzymaktivität aktivieren oder inhibieren können die Produktion bestimmter Produkte.
Enzyme sind Proteine, die biochemische Reaktionen im menschlichen Körper helfen. Eine der wichtigsten Rollen von Enzymen ist die Verdauung. Enzyme helfen auch beim Atmen, aufbauen Muskeln, Nervenfunktion und Entfernen von Toxinen im Körper. Enzyme haben unterschiedliche Bereiche in der Struktur, in der Moleküle Reaktionen binden und katalysieren können. Allosterische Stellen und aktive Stellen sind zwei verschiedene Bereiche in der Enzymstruktur, die die Bindung der Moleküle und nachfolgende chemische Reaktionen erleichtern.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist eine allosterische Seite
3. Was ist ein aktives Zentrum
4. Ähnlichkeiten -allosterische Website und aktives Zentrum
5. Allosterische Site vs aktives Zentrum in tabellarischer Form
6. Zusammenfassung - Allosterische Website gegen aktives Zentrum
Was ist eine allosterische Seite?
Die allosterische Stelle ist eine Region eines Enzyms, mit dem Aktivator- oder Inhibitormoleküle an das Enzym binden, das die Enzymaktivität entweder aktiviert oder hemmt. Enzyme arbeiten je nach Umwelt bei unterschiedlichen Temperaturen. Mehrere Faktoren, einschließlich Schärfe, Kälte, pH, Ort im Körper und anderen Substanzen, beeinflussen zusätzlich zum Hauptsubstrat die Enzymaktivität. Es gibt einige Substanzen, die an einem anderen Ort als dem normalen aktiven Standort an das Enzym binden. Diese Stellen, die andere Substanzen zulässt, werden als allosterische Stellen bezeichnet. Mit allosterischen Stellen können andere Substanzen die Enzymaktivität entweder aktivieren, hemmen oder ausschalten. Dies geschieht, wenn andere Substanzen an die allosterische Stelle binden und die Bestätigung oder Form des Enzyms ändern.

Abbildung 01: Allosterische Stelle
Ein Beispiel für allosterischer Aktivator ist die Sauerstoffbindung an Hämoglobin. Die allosterische Bindung von Sauerstoff an Hämoglobin verändert die Bestätigung von Hämoglobin und erhöht seine Affinität zu mehr Sauerstoff. Dieses Verfahren sorgt dafür, dass das Hämoglobin die maximale Sauerstoffmenge aus sauerstoffreichen Bereichen wie der Lunge transportiert. Ein weiteres Beispiel für allosterischer Inhibitor ist ein ATP bei der Zellatmung. Ein wichtiges Enzym, das an der Glykolyse beteiligt ist. Dieses Enzym konvertiert ADP in ATP. Wenn es zu viel ATP in der Zelle gibt.
Was ist ein aktives Zentrum?
Das aktive Zentrum ist die Region eines Enzyms, in dem Substratmoleküle binden und eine Reaktion zur Herstellung von Produkten unterzogen werden. Das aktive Standort ist weiter in zwei verschiedene Stellen unterteilt: Bindungsstelle und kalalytische Stelle. In der Bindungsstelle bilden Aminosäurereste der aktiven Zentrum temporäre Bindungen mit dem Substrat. Andererseits katalysieren am katalytischen Ort Aminosäurereste der aktiven Stelle eine Reaktion dieses Substrats.
Abbildung 02: Aktive Zentrum
Das aktive Zentrum eines Enzyms hat normalerweise drei bis vier Aminosäuren, während andere Aminosäuren im Enzym erforderlich sind, um die Tertiärstruktur des Enzyms aufrechtzuerhalten. Ein aktives Zentrum eines Enzyms kann eine Reaktion wiederholt katalysieren, da am Ende der Reaktion die Reste nicht verändert werden. Dieser Prozess wird normalerweise durch Senkung der Aktivierungsenergie der Reaktion erreicht. Daher haben mehr Substrate genug Energie, um einer chemischen Reaktion zu unterziehen.
Was sind die Ähnlichkeiten zwischen allosterischer Stelle und aktivem Standort??
- Allosterische Stelle und aktives Zentrum sind zwei verschiedene Bereiche in der Enzymstruktur, die die Bindung der Moleküle und nachfolgende chemische Reaktionen erleichtern.
- Beide Standorte bestehen aus Aminosäuren.
- Diese Websites haben eine einzigartige Form.
- Beide Stellen sind sehr wichtig für die Enzymaktivität und die enzymkatalysierte Reaktion.
Was ist der Unterschied zwischen allosterischer Stelle und aktivem Standort?
Die allosterische Stelle ist eine Region eines Enzyms, mit dem Aktivator- oder Inhibitormoleküle an das Enzym binden können, um die Enzymaktivität zu aktivieren oder zu hemmen, während die aktive Stelle eine Region eines Enzyms ist, in dem Substratmoleküle die in der Produktion von der Produktion von resultierende Reaktion binden und katalysieren bestimmte Produkte. Dies ist daher der Hauptunterschied zwischen allosterischer Standort und aktivem Standort. Darüber hinaus sind allosterische Stellen nur in allosterischen Enzymen vorhanden, während aktive Stellen in allen Enzymen vorhanden sind.
Die folgende Infografik stellt die Unterschiede zwischen allosterischer Stelle und aktivem Standort in tabellarischer Form für Seite für Seitenvergleich vor.
Zusammenfassung -Allosterische Website gegen aktives Zentrum
Allosterische Stelle und aktives Zentrum sind zwei verschiedene Regionen in der Enzymstruktur. Die allosterische Stelle ist eine Region eines Enzyms, mit dem Aktivator- oder Inhibitormoleküle an das Enzym binden, das die Enzymaktivität entweder aktiviert oder hemmt Produkte. Dies ist also der Hauptunterschied zwischen allosterischer Standort und aktivem Standort.
Referenz:
1. "Aktive Seite.”Ein Überblick | Sciencedirect -Themen.
2. „Was ist ein allosterischer Ort des Enzyms? - Definition & Biologie." Lernen.com.
Bild mit freundlicher Genehmigung:
1. "Abbildung 06 05 05" von CNX OpenStax - (cc von 4.0) über Commons Wikimedia
2. "SI Active Site" von ASID3 - eigene Arbeit (CC BY -SA 4.0) über Commons Wikimedia


