Was ist der Unterschied zwischen Ammoniak und Bor Trifluorid
Der Schlüsselunterschied zwischen Ammoniak und Bor Trifluorid ist, dass Ammoniak ein polares Molekül ist, während Bor -Trifluorid ein unpolares Molekül ist.
Ammoniak und Bor -Trifluorid haben eine ähnliche Atomität und eine eng ähnliche Konnektivität von Atomen. Diese Tatsache macht Ammoniak zu einem polaren Molekül und Bor -Trifluorid zu einem unpolaren Molekül.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Ammoniak
3. Was ist Bor Trifluorid
4. Ammoniak gegen Bor Trifluorid in tabellarischer Form
5. Zusammenfassung
Was ist Ammoniak?
Ammoniak ist eine anorganische Verbindung mit der chemischen Formel NH3. Es ist eine gasförmige Substanz und das einfachste Pnictogen -Hydrid. Ammoniak tritt als farbloses Gas mit einem scharfen, irritierenden Geruch auf. Der IUPAC -Name Ammoniak ist Azane. Die Molmasse von Ammoniak beträgt 17.03 g/mol. Sein Schmelzpunkt beträgt –77.73 ° C, und sein Siedepunkt beträgt –33.34 ° C.
Bei der Betrachtung des Auftretens von Ammoniakgas tritt es natürlich in der Umwelt vor. Manchmal finden wir auch Ammoniak im Regenwasser. In unserem Körper sezernieren Nieren Ammoniak, um überschüssige Säure zu neutralisieren.
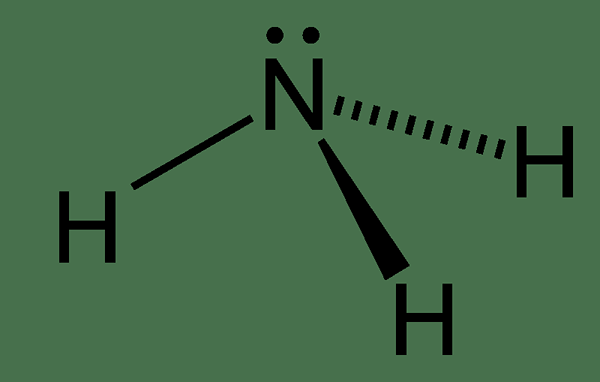
Abbildung 01: Ammoniak
Die chemische Struktur des Ammoniakmoleküls hat ein Stickstoffatom, das an drei Wasserstoffatome gebunden ist. Da es fünf Elektronen in der äußersten Elektronenhülle des Stickstoffs gibt, gibt es ein einsames Elektronenpaar am Stickstoffatom des Ammoniakmoleküls. Daher ist die Geometrie des Ammoniakmoleküls trigonaler Pyramiden. Darüber hinaus können wir diese Verbindung leicht verflüssigen. Dies liegt daran, dass es in der Lage ist, Wasserstoffbrückenbindungen zwischen Ammoniakmolekülen zu bilden.
Was ist Bor Trifluorid?
Boron Trifluorid ist eine anorganische Verbindung mit der chemischen Formel BF3. Es ist ein scharfe Gas, das farblos und giftig ist. Es kann weiße Dämpfe in feuchter Luft bilden. Es gibt jedoch zwei Hauptformen von Bor -Trifluorid als wasserfreie Form und Dihydratform; Die wasserfreie Form ist ein farbloses Gas, während Dihydratform eine farblose Flüssigkeit ist. Bei der Betrachtung ihrer Löslichkeit in Wasser wird die wasserfreie Form eine exotherme Zersetzung unterzogen, wenn sie in Wasser zugesetzt werden, während die Dihydratform hoch wasserlöslich ist. Diese Substanz ist ätzend, daher müssen wir Edelstahl, Monel und Hastelloy zur Lagerung dieser Substanz verwenden.

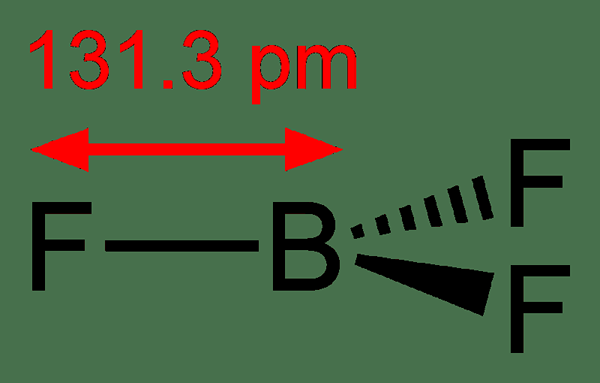
Abbildung 02: Bor Trifluorid
Das Bor -Trifluorid -Molekül hat eine trigonale planare Geometrie. Es hat keinen Dipolmoment wegen seiner Symmetrie. Dieses Molekül ist isoelektronisch mit Carbonatanion. Wir nennen wir Boron Trifluorid als chemische Spezies mit elektronenmangelig. Es hat eine exotherme Reaktivität mit Lewis -Basen.
In der Synthese von Bor -Trifluorid können wir es aus der Reaktion zwischen Boroxiden und Wasserstofffluorid produzieren. In Laborbedürfnissen können wir jedoch Bor Trifluorid unter Verwendung von Bor Trifluoridetherat (einer im Handel erhältlichen Flüssigkeit) produzieren (eine im Handel erhältliche Flüssigkeit).
Was ist der Unterschied zwischen Ammoniak und Bor Trifluorid?
Ammoniak und Bor Trifluorid sind 4-Atom-Moleküle, beide mit einem zentralen Atom mit drei anderen Atomen gebunden. Im Gegensatz zum Bor -Trifluorid -Molekül gibt es jedoch ein einsames Elektronenpaar im Ammoniakmolekül, das es polar macht. Daher besteht der Hauptunterschied zwischen Ammoniak und Bor -Trifluorid darin.
Die folgende Infografik listet den Unterschied zwischen Ammoniak und Bor -Trifluorid in tabellarischer Form für Seite für Seitenvergleich auf.
Zusammenfassung -Ammoniak gegen Bor Trifluorid
Ammoniak ist eine anorganische Verbindung mit der chemischen Formel NH3, Während Bor Trifluorid eine anorganische Verbindung mit der chemischen Formel BF3 ist. Der Schlüsselunterschied zwischen Ammoniak und Bor -Trifluorid besteht darin.
Referenz:
1. „Synthese von Ammoniak: Prozess und Reaktion." Lernen.com
Bild mit freundlicher Genehmigung:
1. "Ammonia-2d" von Radio89-eigene Arbeit (CC BY-SA 3.0) über Commons Wikimedia
2. "Boron-Tfluorid-2D-Dimensionen" von Ben Mills-eigene Arbeit (Public Domain) über Commons Wikimedia


