Was ist der Unterschied zwischen Calciumacetat und Calciumcarbonat

Der Schlüsselunterschiede zwischen Calciumacetat und Calciumcarbonat ist, dass Calciumcarbonat eine hohe Menge elementarer Kalzium als Calciumacetat enthält.
Calciumacetat ist eine chemische Verbindung, die als Kalziumsalz aus Essigsäure identifiziert werden kann. Calciumcarbonat ist ein Carbonat aus Kalzium und hat die chemische Formel CACO3. Beide sind Calciumsalzverbindungen mit ionischen Naturen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Calciumacetat
3. Was ist Calciumcarbonat
4. Calciumacetat gegen Calciumcarbonat in tabellarischer Form
5. Zusammenfassung -Calciumacetat gegen Calciumcarbonat
Was ist Calciumacetat?
Calciumacetat ist eine chemische Verbindung, die als Kalziumsalz aus Essigsäure identifiziert werden kann. Diese Verbindung hat die chemische Formel CA (C2H3O2) 2. Obwohl der Standardname dieser Verbindung Calciumacetat ist, lautet sein systemischer Name Kalziumethanoat. Es wurde auch genannt Acetat von Kalk.

Abbildung 01: Chemische Struktur von Calciumacetat
Die Produktion von Calciumacetat kann durch Einweichen von Calciumcarbonat oder hydratisiertem Kalk in Essig erreicht werden. Die Quellen von Calciumcarbonat umfassen Eierschalen, Kalkstein, Marmor und andere Carbonatgesteine.
Es gibt unterschiedliche Verwendungen von Calciumacetat, einschließlich Senkung des Blutphosphatspiegels, als Nahrungsmittelzusatz, als Stabilisator für Lebensmittel, Produktion von Tofu, als Ausgangsmaterial für die Acetonproduktion usw.
Die Molmasse von Calciumacetat beträgt 158.16 g/mol. Es erscheint als weißer Feststoff, der hygroskopisch ist. Darüber hinaus ist diese Substanz mit Essigsäuregeruch leicht gerüstet. Die Dichte von Calciumacetat beträgt ungefähr 1.5 g/cm3. An seinem Schmelzpunkt oder höhere Temperaturen können wir die Zersetzung von Calciumacetat in Calciumcarbonat und Aceton beobachten. Darüber hinaus ist Calciumacetat in Methanol und Hydrazin leicht löslich, während es in Aceton, Ethanol und Benzol unlöslich ist.
Was ist Calciumcarbonat?
Calciumcarbonat ist ein Carbonat aus Kalzium, das die chemische Formel CACO3 hat. Calciumcarbonat tritt natürlich als Kalkstein, Kreide, Calcit usw. auf. Daher ist es eine häufige Substanz in Felsen. Ex: Calcit oder Aragonit (Kalkstein enthält beide Formen). Calciumcarbonat tritt als weiße hexagonale Kristalle oder Pulver auf und ist geruchlos.
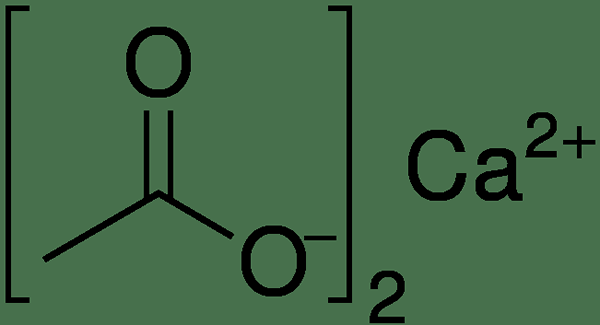
Abbildung 02: Calciumcarbonat -Feststoffform
Darüber hinaus hat Calciumcarbonat einen kalkhaltigen Geschmack. Die Molmasse dieser Verbindung beträgt 100 g/mol und der Schmelzpunkt beträgt 1.339 ° C (für die Calcit -Form). Es hat jedoch keinen Siedepunkt, da sich diese Verbindung bei hohen Temperaturen zersetzt. Wir können diese Verbindung durch Bergbau von Calcium-tragenden Mineralien erhalten. Aber diese Form ist nicht rein. Wir können eine reine Form mit einer reinen abgebranten Quelle wie Marmor erhalten. Wenn Calciumcarbonat mit Säuren reagiert, bildet es CO2 -Gas. Wenn es mit Wasser reagiert, bildet es Calciumhydroxid. Zusätzlich zu diesen kann es sich einer thermischen Zersetzung unterziehen und CO2 -Gas freigeben.
Was ist der Unterschied zwischen Calciumacetat und Calciumcarbonat?
Calciumacetat ist eine chemische Verbindung, die als Kalziumsalz aus Essigsäure identifiziert werden kann. Calciumcarbonat ist ein Carbonat aus Kalzium, das die chemische Formel CACO3 hat. Der Schlüsselunterschied zwischen Calciumacetat und Calciumcarbonat besteht darin.
Die folgende Infografik zeigt die Unterschiede zwischen Calciumacetat und Calciumcarbonat in tabellarischer Form für Seite für Seitenvergleich.
Zusammenfassung -Calciumacetat gegen Calciumcarbonat
Sowohl Calciumacetat als auch Calciumcarbonat sind ionische Verbindungen. Der Schlüsselunterschied zwischen Calciumacetat und Calciumcarbonat ist ihr elementarer Calciumgehalt. Calciumcarbonat enthält eine hohe Menge elementarer Kalzium als Calciumacetat
Referenz:
1. Kalantar-Zadeh, Kamyar und Joel D. Kopple. Ernährungsbewirtschaftung von Erhaltung Hämodialysepatienten. 2022.
Bild mit freundlicher Genehmigung:
1. "Calciumacetat" von gkfxtalk (SVG), Edgar181 bei English Wikipedia (PNG) - Datei: Calcium_acetate.PNG, vektorisiert von gkfxtalk (öffentlich -domäne) über Commons Wikimedia
2. "Calciumcarbonat" - Bild aufgenommen im August 2005 von Benutzer: Walkroma., Öffentlich zugänglich) über Commons Wikimedia


