Was ist der Unterschied zwischen Dipol -Dipol -Wechselwirkungen und Wasserstoffbrückenbindung
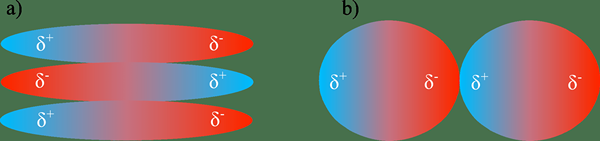
Der Schlüsselunterschied zwischen Dipol -Dipol -Wechselwirkungen und Wasserstoffbrückenbindung Damit Dipol -Dipol -Wechselwirkungen auftreten, wenn teilweise negativ geladene Moleküle mit einem benachbarten Molekül mit einer positiven Ladung interagieren, während die Wasserstoffbrückenbindung eine spezielle Art von starker Dipolbindung ist, die zwischen O, N und F und H Atome auftritt.
Dipol-Dipol-Wechselwirkungen und Wasserstoffbrückenbindungen sind sehr wichtige Phänomene bei der Untersuchung der molekularen Bindung, des molekularen Verhaltens, der Kristallstrukturen und vielen anderen chemischen Tatsachen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind Dipol -Dipol -Wechselwirkungen
3. Was ist Wasserstoffbrückenbindung
4. Dipol -Dipol -Wechselwirkungen gegen Wasserstoffbrückenbindung in tabellarischer Form
5. Zusammenfassung -Dipol -Dipol -Wechselwirkungen gegen Wasserstoffbrückenbindung
Was sind Dipol -Dipol -Wechselwirkungen?
Dipol-Dipol-Wechselwirkungen oder Dipol-Dipolkräfte sind intermolekulare Kräfte, die zwischen polaren Molekülen auftreten. Dies sind elektrostatische Kräfte. Bei der Bildung dieser Krafttyp werden polare Moleküle tendenziell ausgerichtet, so dass die Anziehungskraft zwischen den Molekülen maximiert wird, indem die Potentialergie reduziert wird. Diese Ausrichtung reduziert auch die Abstoßungen zwischen den Molekülen.

Bei Betrachtung einer Reihe von Verbindungen mit ähnlichen Molmassen (die Dipol-Dipol-Wechselwirkungskräfte zwischen Molekülen aufweisen) steigt die Stärke der Dipol-Dipolkräfte mit zunehmendem Polarität an. Dies geschieht, weil die Ladungstrennung hoch ist, wenn die Polarität hoch ist. Wenn das Molekül eine hohe Ladungsabtrennung aufweist (hoch aufgeladene positive und negative Terminals im selben Molekül), zieht es tendenziell entgegengesetzte Ladungen an. Dies führt auch zu einem Anstieg des Siedepunkts von Verbindungen. Größer die Dipol-Dipolkräfte, desto größer der Siedepunkt.
Was ist Wasserstoffbrückenbindung?
Eine Wasserstoffbindung kann als eine Art Anziehungskraft zwischen zwei Atomen von zwei verschiedenen Molekülen beschrieben werden. Es ist eine schwache Anziehungskraft. Im Vergleich zu anderen Arten von intramolekularen Kräften wie polarpolaren Wechselwirkungen und nichtpolar-nichtpolaren Wechselwirkungen wie Vander Waal Forces ist die Wasserstoffbindung jedoch viel stärker.
Typischerweise bilden sich Wasserstoffbrückenbindungen zwischen polaren kovalenten Molekülen. Diese Moleküle enthalten polare kovalente Bindungen, die sich aufgrund der Differenz der Elektronegativitätswerte der Atome, die sich in der kovalenten Bindung befinden. Wenn dieser Unterschied hoch ist, zieht das hoch elektronegative Atom die Bindungselektronen zu sich selbst an. Dies schafft ein Dipolmoment, in dem dieses hoch elektronegative Atom eine teilweise negative Ladung erhält, während das andere Atom eine teilweise positive Ladung erhält. Dann wird die Bindung zu einer polaren kovalenten Bindung. Wenn dieses Molekül ein anderes Molekül triff. Diese Anziehungskraft wird als Wasserstoffbindung bezeichnet.
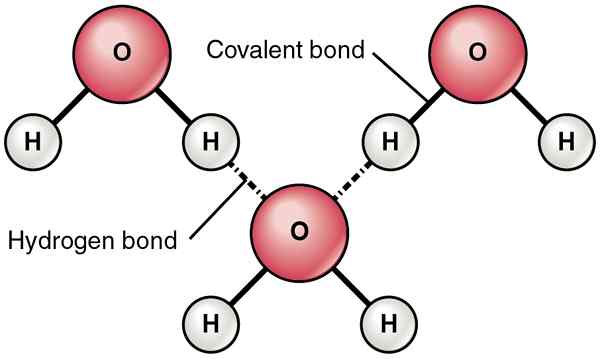
Darüber hinaus werden Wasserstoffbrückenbindungen zwischen hochelektronegativen Atomen und weniger elektronegativen Atomen gebildet. Außerdem existieren sie, wenn wir O, N und F in einem Molekül und positiv geladenem H im anderen Molekül haben. Dies liegt daran, dass F, n und o die elektronegativsten Atome sind, die Wasserstoffbrückenbindungen bilden können.
Was ist der Unterschied zwischen Dipol -Dipol -Wechselwirkungen und Wasserstoffbrückenbindung?
Der Schlüsselunterschied zwischen Dipol-Dipol-Wechselwirkungen und Wasserstoffbrückenbindung besteht darin, dass Dipol-Dipol-Wechselwirkungen auftreten, wenn teilweise negativ geladene Moleküle mit einem benachbarten Molekül mit einer positiven Ladung interagieren, während die Wasserstoffbrückenbindung eine spezielle Art von starker Dipol-Dipol-Bindung ist, die zwischen O, N auftritt , F und H Atome.
Die folgende Infografik zeigt die Unterschiede zwischen Dipol-Dipol-Wechselwirkungen und Wasserstoffbrückenbindung in tabellarischer Form für den Nebenseitigen Vergleich.
Zusammenfassung -Dipol -Dipol -Wechselwirkungen gegen Wasserstoffbrückenbindung
Dipol-Dipol-Wechselwirkungen sind intermolekulare Kräfte, die zwischen polaren Molekülen auftreten, während die Wasserstoffbrücke eine Art Anziehungskraft zwischen zwei Atomen von zwei verschiedenen Molekülen ist. Der Schlüsselunterschied zwischen Dipol -Dipol -Wechselwirkungen und Wasserstoffbrückenbindung besteht darin, dass Dipol -Dipol -Wechselwirkungen auftreten, wenn teilweise negativ geladene Moleküle mit einem benachbarten Molekül mit einer positiven Ladung interagieren, während die Wasserstoffbindung eine spezielle Art von starker Dipol -Dipol -Bindung ist, die zwischen O, n, N,, ist und F- und H -Atome.
Referenz:
1. „Wasserstoffbrücke.” Chemie -Libretexten, Libretexten, 11. September. 2022.
Bild mit freundlicher Genehmigung:
1. "Dipol -Interaktionen" von Adam Rędzikowski - Datei: Dipole_Interactions.PNG (CC BY-SA 3.0) über Commons Wikimedia
2. "210 Wasserstoffbrückenbindungen zwischen Wassermolekules -01" vom OpenStax College - Anatomy & Physiology, Connexions -Website. 19. Juni 2013. (CC von 3.0) über Commons Wikimedia


