Was ist der Unterschied zwischen dem Gesetz von Gay-Lussac und dem Avogadro-Gesetz
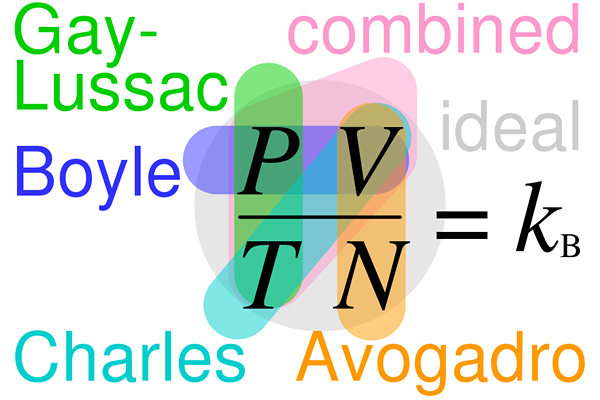
Der Hauptunterschied zwischen dem Gesetz von Gay-Lussac und dem Avogadro-Gesetz ist, dass das Gay-Lussac-Gesetz angibt, dass das Volumen eines Gases direkt proportional zur Temperatur des Gases ist, während das Avogadro-Gesetz besagt, dass das Volumen eines Gases direkt proportional zur Anzahl der Moleküle im Gas ist.
Gay-Lussac-Gesetz beschreibt den variierenden Druck einer bestimmten Masse eines Gases direkt mit der absoluten Temperatur des Gases auf konstantem Volumen. Das Avogadro -Gesetz ist ein experimentelles Gasgesetz, das besagt.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist das Gesetz von Gay-Lussac?
3. Was ist Avogadro -Gesetz?
4. Gay-Lussac's Law gegen Avogadros Gesetz in tabellarischer Form
5. Zusammenfassung -Gay -Lussac's Law gegen Avogadros Gesetz
Was ist das Gesetz von Gay-Lussac??
Gay-Lussac-Gesetz beschreibt den variierenden Druck einer bestimmten Masse eines Gases direkt mit der absoluten Temperatur des Gases auf konstantem Volumen. Es wird manchmal Amontons Gesetz genannt. Wir können einen mathematischen Ausdruck für dieses Gesetz geben wie folgt:
P/t = k
In dieser Gleichung bezieht sich P auf den Druck, t auf die absolute Temperatur, und K ist eine Konstante. Wir können sagen, dass dies ein besonderer Fall von idealem Gasrecht ist.
Eine Ableitung dieses Gesetzes ist das Druck-Temperaturgesetz, das die Beziehung zwischen dem Druck und der Temperatur einer bestimmten Masse eines Gases in einem konstanten Volumen beschreibt.
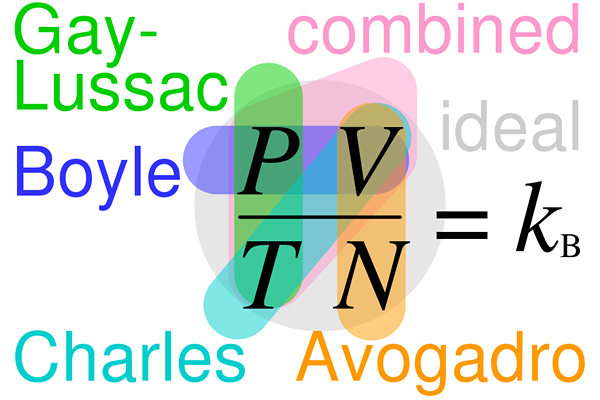
Nach dem Gesetz der Kombination von Volumina reagieren Gase mit einem Volumen miteinander und reagieren im einfachen Ganzzahlenverhältnis bei konstanten Temperatur- und Druckbedingungen. Mit anderen Worten, das Verhältnis zwischen den Volumina der Reaktantengase und den gasförmigen Produkten kann in einfachen ganzen Zahlen angegeben werden. Gay Lussac war einer der ersten Wissenschaftler, die diese Beziehung entdeckten, was zur Ableitung des Avogadro -Gesetzes führte.
Was ist Avogadro -Gesetz??
Das Avogadro -Gesetz ist ein experimentelles Gasgesetz, das besagt. Es heißt auch Avogadros Hypothese oder Avogadro -Prinzip. Dies ist eine bestimmte Form des idealen Gasgesetzes. Dieses Gesetz wurde 1812 nach Amedeo Avogadro benannt.
Nach modernen Beschreibungen besagt das Gesetz von Avogadro, dass gleiche Volumina aller Gase, die sich in gleicher Temperatur- und Druckbedingung befinden, die gleiche Anzahl von Molekülen aufweisen. Zum Beispiel bestehen gleiche Volumina von Wasserstoffgas und Stickstoffgas aus einer gleichen Anzahl von Atomen, wenn sich diese beiden Gase in der gleichen Temperatur und dem gleichen Druck befinden. Praktisch zeigen echte Gase kleine Abweichungen vom idealen Gasverhalten, bei dem das Gesetz nur ungefähr genau ist. Es ist jedoch immer noch eine wichtige Annäherung für Wissenschaftler. Mathematisch ist das Gesetz wie folgt:
V/n = k
Wobei V das Volumen des Gases ist, n ist die Substanzmenge des Gases in der Probe, und k ist ein konstanter Wert für eine bestimmte Temperatur und Druck.
Unterschied zwischen dem Gesetz von Gay-Lussac und dem Avogadro-Gesetz
Das Gay-Lussac-Gesetz und das Avogadro-Gesetz sind zwei wichtige Gasgesetze. Der Hauptunterschied zwischen dem Gesetz von Gay-Lussac und dem Gesetz von Avogadro besteht darin, dass das Gay-Lussac-Gesetz darauf hinweist von Molekülen im Gas.
Die folgende Tabelle fasst den Unterschied zwischen dem Gesetz von Gay-Lussac und dem Avogadro-Gesetz zusammen.
Zusammenfassung -Gay -Lussac's Law gegen Avogadros Gesetz
Das Gay-Lussac-Gesetz und das Avogadro-Gesetz sind zwei wichtige Gasgesetze. Der Hauptunterschied zwischen dem Gesetz von Gay-Lussac und dem Gesetz von Avogadro besteht darin, dass das Gay-Lussac-Gesetz darauf hinweist von Molekülen im Gas.
Referenz:
1. „Gay -Lussacs Gesetz - Aussage, Formel, detaillierte Erklärung.” Byjus, 25. März. 2021.
Bild mit freundlicher Genehmigung:
1. "Ideal Gas Law Beziehungen" von Cmglee - eigene Arbeit (CC BY -SA 4.0) über Commons Wikimedia


