Was ist der Unterschied zwischen dem ionischen Gleichgewicht und dem chemischen Gleichgewicht
Der Schlüsselunterschied zwischen dem ionischen Gleichgewicht und dem chemischen Gleichgewicht ist, dass das ionische Gleichgewicht zwischen organisierten Molekülen und Ionen in einem Elektrolyten auftritt, während ein chemisches Gleichgewicht zwischen chemischen Reaktanten und Produkten auftritt.
Ionisches und chemisches Gleichgewicht sind wichtige Phänomene in der Chemie. Das Ionengleichgewicht ist das Gleichgewicht, das zwischen organisierten Molekülen und den Ionen in einer Lösung schwacher Elektrolyte festgelegt wird. Chemisches Gleichgewicht ist der Zustand, in dem sowohl Reaktanten als auch Produkte in Konzentrationen vorhanden sind, die keine weitere Tendenz haben, sich mit der Zeit zu ändern.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist ein ionisches Gleichgewicht
3. Was ist chemisches Gleichgewicht
4. Ionengleichgewicht gegen chemisches Gleichgewicht in tabellarischer Form
5. Zusammenfassung - ionisches Gleichgewicht gegen chemisches Gleichgewicht
Was ist ein ionisches Gleichgewicht?
Ionisches Gleichgewicht kann als das zwischen den organisierte Molekülen und den Ionen festgelegte Gleichgewicht in einer Lösung schwacher Elektrolyte beschrieben werden. Im Allgemeinen misst pH die Säure oder Alkalität einer Lösung. Dies liegt daran, dass Säuren dazu neigen, Wasserstoffionen in die Lösung freizusetzen. Wenn ein sparsam lösliches Salz in Wasser gelöst wird, wird ein ionisches Gleichgewicht erzeugt.
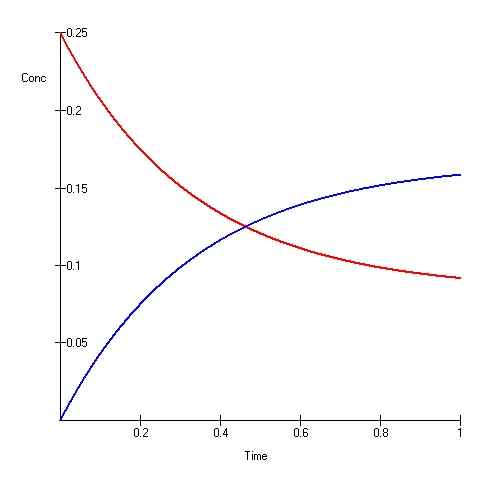
Das ionische Gleichgewicht ist auch eine Art von Gleichgewicht, bei der sich die Produktmengen und Reaktanten im Laufe der Zeit nicht ändern. Dies bedeutet jedoch nicht, dass die Reaktion aufgehört hat; Vielmehr geht die Reaktion auf eine Weise fort, die die Mengen unverändert hält (die Nettoänderung ist Null).
Das ionische Gleichgewicht wird auch als „dynamisches Gleichgewicht“ bezeichnet.”In dieser Art von Gleichgewicht ist die Reaktion reversibel und fortgesetzt. Damit ein dynamisches Gleichgewicht stattfinden kann, sollte das System geschlossen sein, so dass keine Energie oder Materie aus dem System entkommt.
Was ist chemisches Gleichgewicht?
Chemisches Gleichgewicht kann als der Zustand beschrieben werden, in dem sowohl Reaktanten als auch Produkte in Konzentrationen vorhanden sind, die keine weitere Tendenz haben, sich mit der Zeit zu ändern. Einige Reaktionen sind reversibel und einige Reaktionen sind irreversibel. In einer Reaktion konvertieren Reaktanten in Produkte. Bei einigen Reaktionen werden Reaktanten erneut aus den Produkten erzeugt. Daher ist diese Art von Reaktion reversibel.
Bei irreversiblen Reaktionen regenerieren sie nach der Umwandlung der Reaktanten in Produkte nicht wieder von den Produkten. In einer reversiblen Reaktion, wenn Reaktanten Produkte gehen, nennen wir es eine Vorwärtsreaktion, und wenn die Produkte zu Reaktanten werden, ist es eine Rückwärtsreaktion.

Wenn die Rate der Vorwärts- und Rückwärtsreaktionen gleich ist, liegt die Reaktion im Gleichgewicht auf. Daher ändert sich die Menge an Reaktanten und Produkten in einigen Zeiten nicht. Reversible Reaktionen neigen immer dazu, zum Gleichgewicht zu kommen und dieses Gleichgewicht zu behalten. Wenn sich das System in einem Gleichgewicht befindet, sind die Produktmenge und die Reaktanten nicht unbedingt gleich. Es kann eine höhere Menge an Reaktanten geben als Produkte oder umgekehrt. Die einzige Anforderung in einer Gleichgewichtsgleichung ist die Aufrechterhaltung einer konstanten Menge von beiden über die Zeit. Für eine Reaktion im Gleichgewicht können wir eine Gleichgewichtskonstante definieren wie folgt: wo es gleich dem Verhältnis zwischen der Produktkonzentration und der Konzentration von Reaktionen ist.
Bei einer Gleichgewichtsreaktion ist die Rückwärtsreaktion, wenn die Vorwärtsreaktion exotherm ist, endotherm und umgekehrt. Normalerweise sind alle anderen Parameter für Vorwärts- und Rückwärtsreaktionen wie diese entgegengesetzt. Wenn wir also eine der Reaktionen erleichtern wollen, müssen wir einfach die Parameter einstellen, um diese Reaktion zu erleichtern.
Was ist der Unterschied zwischen dem ionischen Gleichgewicht und dem chemischen Gleichgewicht?
Ionisches und chemisches Gleichgewicht sind wichtige Phänomene in der Chemie. Der Schlüsselunterschied zwischen dem ionischen Gleichgewicht und dem chemischen Gleichgewicht besteht darin.
Die folgende Infografik zeigt die Unterschiede zwischen dem ionischen Gleichgewicht und dem chemischen Gleichgewicht in tabellarischer Form für Seite für Seitenvergleich.
Zusammenfassung -ionisches Gleichgewicht gegen chemisches Gleichgewicht
Das ionische Gleichgewicht ist das Gleichgewicht, das zwischen den gewerkschaftlichen Molekülen und den Ionen in einer Lösung schwacher Elektrolyte festgelegt wird. Chemisches Gleichgewicht ist der Zustand, in dem sowohl Reaktanten als auch Produkte in Konzentrationen vorhanden sind, die keine weitere Tendenz haben, sich mit der Zeit zu ändern. Der Schlüsselunterschied zwischen dem ionischen Gleichgewicht und dem chemischen Gleichgewicht besteht darin.
Referenz:
1. „Einführung, Typen und Funktionen des ionischen Gleichgewichts.” Kullabs.
Bild mit freundlicher Genehmigung:
1. "CNX Chem 13 04 Icetable25 IMG" von OpenStax - (CC von 4.0) über Commons Wikimedia
2. "Chemisches Gleichgewicht" von V8RIK an der englischsprachigen Wikipedia (CC BY-SA 3.0) über Commons Wikimedia


