Was ist der Unterschied zwischen Quecksilberzellen und Zwerchfellzelle
Der Schlüsselunterschied zwischen Quecksilberzelle und Zwerchfellzelle ist, dass eine Quecksilberzelle normalerweise eine höhere Spannung und mehr Energie benötigt als eine Zwerchfellzelle.
Wir können Quecksilberzellen, Zwerchfellzellen und Membranzellen verwenden, um Chlor- und Ätznatronen im industriellen Maßstab zu produzieren. Bei allen Methoden besteht die Basis darin, die Natriumchloridlösung zu elektrolyisieren.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist eine Quecksilberzelle
3. Was ist eine Membranzelle
4. Quecksilberzelle gegen Membranzelle in tabellarischer Form
5. Zusammenfassung -Quecksilberzelle gegen Membranzelle
Was ist eine Quecksilberzelle?
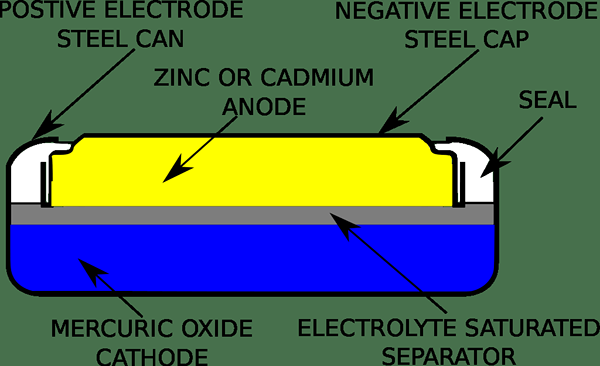
Eine Quecksilberzelle oder eine Quecksilberbatterie ist eine elektrochemische Batterie, die nicht rechbar ist. Wir können es als primäre Zelle kategorisieren und sind auch als bekannt als als Mercuric Oxid -Batterie, Knopfzelle, Und Rubenmallory. Typischerweise verwendet eine Quecksilberbatterie eine Reaktion zwischen Mercuricoxid und Zinkelektroden in einem alkalischen Elektrolyten. Die Spannung der Quecksilberzelle ist 1.35 Volt, wenn die Entladung der Zelle praktisch konstant bleibt. Hier ist die Kapazität viel größer als die Zink-Kohlenstoff-Batterie derselben Größe. Auch in der Vergangenheit wurden diese Batterien als Knopfzellen für Uhren, Hörgeräte, Kameras und Taschenrechner verwendet.

Die Kathode der Quecksilberzelle ist typischerweise entweder reines Quecksilber (II) Oxid oder eine Mischung aus Quecksilber (II) Oxid mit Mangandioxid. Mercuricoxid ist jedoch ein Nicht-Leiter. Daher müssen wir Graphit damit mischen, um die Sammlung von Quecksilber in große Tröpfchen zu verhindern. Außerdem besteht die Anode dieser Zelle im Grunde aus Zink und trennt sich über eine Papierschicht eines porösen Materials, das mit Elektrolyt getränkt ist. Wir nennen dies eine Salzbrücke. Darüber hinaus besteht der Elektrolyt der Quecksilberzelle entweder Natriumhydroxid oder Kaliumhydroxid.
Wenn die elektrischen Merkmale einer Quecksilberzelle berücksichtigt werden, haben diese Zellen, wenn die Kathode Mercuricoxid ist, eine sehr flache Entladungskurve, die die Spannung bei 1 halten kann.35 V bis zu den letzten 5% der Lebensdauer der Zelle. Darüber hinaus bleibt die Spannung mehrere Jahre bei Lichtbelastung innerhalb von 1%. Auf der anderen Seite haben Quecksilberzellen mit Mercuric Oxid und Mangan -Dioxid -Kathode 1.4 V -Ausgang und eine schleuchtere Entladungskurve.
Was ist eine Membranzelle?
Eine Zwerchfellzelle ist eine elektrolytische Zelle. Eine Zwerchfellzelle beinhaltet das Fließen der Salzlösung (die in die Anode eingeführt wird) vom Anodenbereich über das durchlässige Membran zum Kathodenbereich zum Kathodenbereich. In diesem Prozess ist der Anodenbereich über einen durchlässigen Zwerchfell vom Kathodenbereich getrennt. Die Zwerchfellzelle zeigt jedoch weniger Energieeffizienz, geringe Umweltfreundlichkeit und geringe Reinheit des Produkts. Im Vergleich zu dieser Zelle ist die Membranzelle ein optimierter Prozess.
Im Allgemeinen besteht eine Zwerchfellzelle aus einer porösen Mischung aus Asbest und Polymeren. Die Lösung in der Zelle kann durch dieses Material vom Anodenkompartiment zum Kathodenfach sickern. Wir können diese Zelle verwenden, um Chlor aus der Elektrolyse der Natriumchloridlösung zu holen. Die Anode ist normalerweise Titan und die Kathode ist Stahl. Chlor kommt aus der Anode, während Wasserstoff aus der Kathode stammt. Darüber hinaus ist die Lösung, die aus der Kathode herauskommt. Um sicherzustellen, dass der flüssige Fluss nur von Anode zur Kathode auftritt.
Was ist der Unterschied zwischen Quecksilberzellen und Zwerchfellzelle?
Quecksilberzelle und Zwerchfellzelle sind zwei von drei Hauptzellen, mit denen wir sowohl Chlor- als auch ätzende Soda herstellen können. Der Hauptunterschied zwischen Quecksilberzellen und Zwerchfellzelle besteht darin, dass eine Quecksilberzelle normalerweise eine höhere Spannung und mehr Energie benötigt als eine Zwerchfellzelle. Eine Quecksilberzelle hat typischerweise eine Zinkanode und eine Kathode aus reinem Quecksilber (II) Oxid oder einer Mischung aus Quecksilber (II) Oxid mit Mangandioxid. Eine Membranzelle hingegen hat eine Titananode und eine Stahlkathode.
Die folgende Infografik stellt die Unterschiede zwischen Quecksilberzellen und Zwerchfellzellen in tabellarischer Form für den Nebenseitigen Vergleich dar.
Zusammenfassung -Quecksilberzelle gegen Membranzelle
Quecksilberzellen und Zwerchfellzellen sind zwei Zellen, mit denen wir Chlor- und Ätznatronen herstellen können. Der Hauptunterschied zwischen Quecksilberzellen und Zwerchfellzelle besteht darin, dass eine Quecksilberzelle normalerweise eine höhere Spannung und mehr Energie benötigt als eine Zwerchfellzelle.
Referenz:
1. „Zwerchfell- und Membranzelle.” Die Zwerchfell- und Membranzellen für die Herstellung von Chlor. Chemführer.
Bild mit freundlicher Genehmigung:
1. "Mercury Battery2" von SVG Derivat von Rehua, Original von Ted Ankara College Library und Information Center - English Wikipedia (urheberrechtlich geschützt) über Commons Wikimedia


