Was ist der Unterschied zwischen nicht wettbewerbsfähiger und allosterischer Hemmung
Der Schlüsselunterschied zwischen nicht kompetitiver und allosterischer Hemmung ist, dass in der nicht wettbewerbswidrigen Hemmung die maximale Geschwindigkeit der katalysierten Reaktion (VMAX) abnimmt und die Substratkonzentration (KM) unverändert bleibt, während bei allosterischer Hemmung Vmax unverändert bleibt und KM zunimmt.
Enzyme sind für die meisten Reaktionen, die in Organismen stattfinden, unerlässlich. Normalerweise katalysiert ein Enzym eine Reaktion, indem die für die Reaktion erforderliche Aktivierungsenergie reduziert wird. Enzyme sollten jedoch sorgfältig reguliert werden, um die Endprodukte zu kontrollieren, die auf unerwünschte Niveaus steigen. Es wird durch Enzymhemmung kontrolliert. Ein Enzyminhibitor ist ein Molekül, das den normalen Reaktionsweg zwischen einem Enzym und einem Substrat stört.
Ein aktives Zentrum ist die Region eines Enzyms, in dem die Substrate eine chemische Reaktion binden und unterziehen. In einer allosterischen Stelle können Moleküle die Enzymaktivität entweder aktivieren oder hemmen. Die Enzymkinetik spielt eine wichtige Rolle während der Enzymhemmung. Die maximale Reaktionsgeschwindigkeit für ein bestimmtes Enzym in einer bestimmten Konzentration wird als maximale Geschwindigkeit oder Vmax bezeichnet. Die Substratkonzentration, die die Geschwindigkeit ergibt, die die Hälfte von VMAX ist, ist KM.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist eine nicht wettbewerbsfähige Hemmung
3. Was ist eine allosterische Hemmung
4. Ähnlichkeiten - nicht wettbewerbsfähige und allosterische Hemmung
5. Nicht wettbewerbswidrige gegen allosterische Hemmung in tabellarischer Form
6. Zusammenfassung - nicht wettbewerbswidrige gegen allosterische Hemmung
Was ist eine nicht wettbewerbsfähige Hemmung?
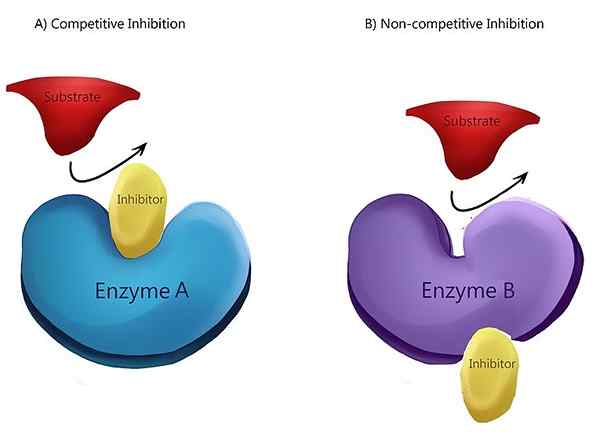
Die nicht wettbewerbsfähige Hemmung ist eine Art von Enzymhemmung, bei der der Inhibitor die Enzymaktivität reduziert und gleich gut an das Enzym bindet, unabhängig davon, ob sie an das Substrat gebunden ist oder nicht. Mit anderen Worten, die nicht wettbewerbsfähige Hemmung bindet der Inhibitor und das Substrat beide zu einem bestimmten Zeitpunkt an das Enzym. Wenn sowohl Substrat als auch Inhibitor mit dem Enzym binden, bildet es einen Enzym-Substrat-Inhibitor-Komplex. Sobald dieser Komplex gebildet ist, kann er kein Produkt produzieren. Es kann nur in den Enzym-Substrat-Komplex oder den Enzym-Inhibitor-Komplex zurückkehren.

Abbildung 01: Nicht-wettbewerbsfähige Hemmung
In der nicht wettbewerbsfähigen Hemmung weist der Inhibitor die gleiche Affinität zum Enzym- und Enzym-Substrat-Komplex auf. Der häufigste Mechanismus eines nicht wettbewerbsfähigen Inhibitors ist die reversible Bindung des Inhibitors an eine allosterische Stelle. Der Inhibitor hat aber auch die Fähigkeit, direkt an das aktive Zentrum zu binden. Ein Beispiel für einen nicht wettbewerbsfähigen Inhibitor ist die Umwandlung von Pyruvatkinase in Pyruvat. Die Umwandlung von Phosphoenolpyruvat in Pyruvat wird durch Pyruvatkinase katalysiert. Eine Aminosäure namens Alanin, die aus Pyruvat synthetisiert wird, hemmt die Enzympyruvatkinase während der Glykolyse. Alanin wirkt als nicht wettbewerbsfähiger Inhibitor.
Was ist eine allosterische Hemmung?
Die allosterische Hemmung ist eine Art von Enzymhemmung, bei der der Inhibitor die Enzymaktivität verlangsamt. Hier konkurriert der Inhibitor nicht direkt mit dem Substrat am aktiven Zentrum. Aber es verändert indirekt die Zusammensetzung des Enzyms. Sobald die Form verändert ist, wird das Enzym inaktiv. Somit kann es nicht mehr an das entsprechende Substrat binden. Dies wiederum verlangsamt die Bildung von Endprodukten.
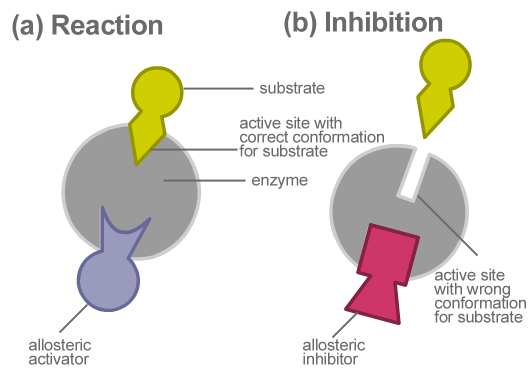
Abbildung 02: Allosterische Hemmung
Die allosterische Hemmung verhindert die Bildung unnötiger Produkte und verringert die Energieverschwendung. Ein Beispiel für eine allosterische Hemmung ist die Umwandlung von ADP in ATP in der Glykolyse. Wenn es hier überschüssige ATP im System gibt, dient ATP als allosterischer Inhibitor. Es bindet an Phosphofroctokinase, das eines der an der Glykolyse beteiligten Enzyme ist. Dies verlangsamt die ADP -Umwandlung. Infolgedessen verhindert ATP die unnötige Produktion von sich selbst. Daher ist eine übermäßige Produktion von ATP nicht erforderlich, wenn ausreichende Mengen vorhanden sind.
Was sind die Ähnlichkeiten zwischen nicht wettbewerbsfähiger und allosterischer Hemmung?
- Beide Arten von Enzymhemmungen verlangsamen die Enzymaktivität.
- Die Inhibitoren in beiden Enzymhemmen konkurrieren nicht mit dem Substrat am aktiven Zentrum.
- Die Inhibitoren verändern die Zusammensetzung des Enzyms indirekt.
- Beide Inhibitoren verändern die Form des Enzyms.
Was ist der Unterschied zwischen nicht wettbewerbsfähiger und allosterischer Hemmung?
Bei der nicht wettbewerbswidrigen Hemmung nimmt der Vmax der Reaktion ab, während der KM-Wert unverändert bleibt. Im Gegensatz dazu bleibt die allosterische Hemmung der VMAX unverändert und der KM -Wert steigt an. Dies ist also der Hauptunterschied zwischen nicht wettbewerbswidriger und allosterischer Hemmung. Die allosterische Hemmung konzentriert sich mehr auf die Verwendung von Chemikalien, die die Enzymaktivität verändert, indem sie an einer allosterischen Stelle binden, während nicht wettbewerbsfähige Inhibitoren das Arbeitsenzym immer stoppen, indem sie direkt an einer alternativen Stelle binden.
Die folgenden Infografik tabelliert die Unterschiede zwischen nicht wettbewerbswidriger und allosterischer Hemmung für Seite an Seitenvergleich.
Zusammenfassung -nicht wettbewerbswidrige gegen allosterische Hemmung
Die nicht wettbewerbsfähige Hemmung ist eine Enzymhemmung, bei der der Inhibitor die Enzymaktivität reduziert und gleich gut an das Enzym bindet, unabhängig davon, ob sie an das Substrat gebunden ist oder nicht. Die allosterische Hemmung ist eine Art von Enzymhemmung, bei der der Inhibitor die Enzymaktivität verlangsamt, indem er das Enzym deaktiviert und an das Enzym an der allosterischen Stelle bindet. Der Schlüsselunterschied zwischen nicht wettbewerbswidriger und allosterischer Hemmung besteht darin Hemmung.
Referenz:
1. „Allosterische Regulation: Protokoll.Jove.
2. „Enzyme.”Grenzlose Mikrobiologie.
Bild mit freundlicher Genehmigung:
1. "Wettbewerbsfähige und nicht wettbewerbsfähige Enzymhemmung" von California16 - eigene Arbeit (CC BY -SA 4.0) über Commons Wikimedia
2. "Allosterische Hemmung" von [[: en: Benutzer: 1 | 1] an der englischsprachigen Wikipedia (CC BY-SA 3.0) über Commons Wikimedia


