Was ist der Unterschied zwischen Sigma und PI -Molekülorbitalen
Der Schlüsselunterschied zwischen Sigma und PI -Molekülorbitalen ist, dass sich Sigma-molekulares Orbital aus der Überlappung von atomaren Orbitalen in Kopf-an-Kopf-Richtung entlang der internukleären Achse bildet, während PI-molekulare Orbitale aus der Überlappung von Atomorbitalen in paralleler Richtung bilden.
Sigma- und PI -Molekülorbitale sind zwei Arten von molekularen Orbitalen, die zur tatsächlichen Struktur einer chemischen Verbindung beitragen. Die molekularen Orbitale sind für die Bildung von Einzel- und Doppel- oder Dreifachbindungen verantwortlich.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind molekulare Orbitale
3. Was sind Sigma Molekulare Orbitale
4. Was sind PI -Molekülorbitale
5. Sigma gegen PI Molekulare Orbitale in tabellarischer Form
6. Zusammenfassung - Sigma gegen PI Molekulare Orbitale
Was sind molekulare Orbitale?
Atome verbinden sich zu Molekülen. Wenn sich zwei Atome näher zusammenbringen, um ein Molekül zu bilden, überlappen sich Atomorbitale und verbinden. Die Anzahl der neu gebildeten molekularen Orbitale entspricht der Anzahl der kombinierten atomaren Orbitale. Darüber hinaus umgibt das molekulare Orbital die beiden Kerne der Atome, und Elektronen können sich um beide Kerne bewegen. Ähnlich wie atomare Orbitale enthalten molekulare Orbitale maximal 2 Elektronen, die entgegengesetzte Spins haben.
Darüber hinaus gibt es zwei Arten von molekularen Orbitalen als Bindungsmolekülorbitale und antibinding molekulare Orbitale. Bindungsmolekülorbitale enthalten Elektronen im Grundzustand, während die Antibindungsmolekülorbitale keine Elektronen im Grundzustand enthalten. Darüber hinaus können Elektronen Antibindungsorbitale einnehmen, wenn sich das Molekül in einem angeregten Zustand befindet.
Was sind Sigma Molekulare Orbitale?
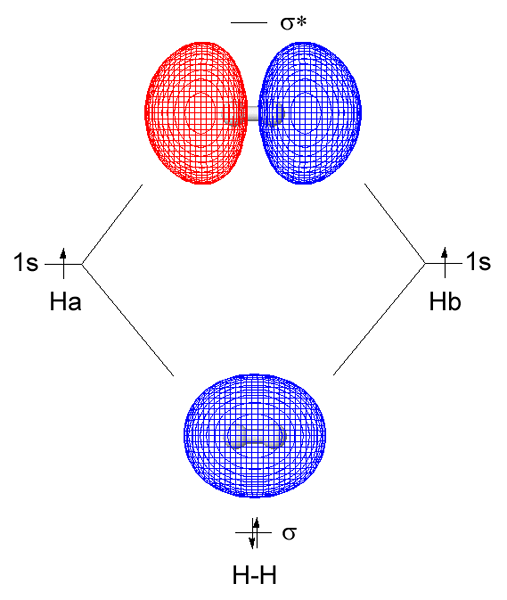
Sigma-Molekularorbitale sind Arten von Hybridorbitalen, die sich aus der Überlappung von zwei Atomorbitalen von Kopf-an-Kopf entlang der internukleären Achse bilden. Typischerweise ist die erste kovalente Bindung zwischen zwei Atomen immer eine Sigma -Bindung. Überlappung von zwei atomaren Orbitalen in der interkernigen Achse bildet eine kovalente Sigma-Bindung. In einem Sigma -molekularen Orbital ist die Elektronendichte in der Mitte des molekularen Orbitals hoch, wenn die beiden Atome, aus denen sich die Atomorbitale überlappen, identisch sind.

Abbildung 01: Wasserstoffmolekül
Bei der Betrachtung von Wasserstoff als Beispiel bildet sich Sigma Molekular Orbital aus der Überlappung von zwei 1S -Atomorbitalen aus jedem Wasserstoffatom. Wir können diese Sigma -Bindung als σ abkürzen. Hier tritt die gemeinsame Elektronendichte direkt zwischen den Bindungsatomen entlang der Bindungsachse auf. Dies macht eine stabilere Wechselwirkung zwischen zwei gebundenen Atomen zusammen mit den Bindungselektronen im Vergleich zur Stabilität der getrennten Atome. Typischerweise ist eine Sigma -Bindung die erste Bindung, die zwischen zwei Atomen bildet.
Was sind PI -Molekülorbitale?
PI -molekulare Orbitale sind Arten von Hybridorbitalen, die sich aus der Überlappung von zwei atomaren Orbitalen in paralleler Richtung bilden. Hier tritt die Bindungselektronendichte über und unter der internukleären Achse auf. Darüber hinaus können wir keine Elektronen an der Bindungsachse beobachten. Diese Art der Wechselwirkung zwischen zwei Atomen bildet eine stabilere Anordnung als die Stabilität getrennter freier Atome. Normalerweise belegen Elektronen diese Art von molekularen Orbitalen, wenn in den Atomen genügend Elektronen vorhanden sind. PI -molekulare Orbitale bilden sich immer als zweite oder dritte molekulare Orbitalbildung in Bezug auf die Bindung von zwei Atomen.
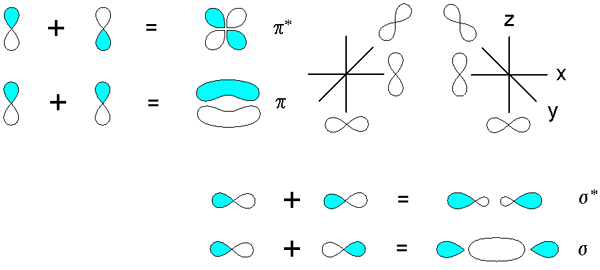
Abbildung 02: PI -Molekülorbitale
Darüber hinaus ist die Anzahl der Atome, die zu einem P -Atom -Orbital des PI -Systems beitragen. Typischerweise hat das niedrigste PI -molekulare Orbital keine vertikalen Knoten vorhanden. Hier erhalten die aufeinanderfolgenden PI -molekularen Orbitale einen zusätzlichen vertikalen Knoten bei Erhöhung der Energie. Wir können ein PI -molekulares Orbital als π abkürzen.
Was ist der Unterschied zwischen Sigma und PI -Molekülorbitalen?
Sigma- und PI -Molekülorbitale sind zwei Arten von molekularen Orbitalen, die zur tatsächlichen Struktur einer chemischen Verbindung beitragen. Der Schlüsselunterschied zwischen Sigma- und PI-Molekularorbitalen besteht darin.
Die folgende Infografik listet die Unterschiede zwischen Sigma und PI -molekularen Orbitalen in tabellarischer Form für Seite für Seitenvergleich auf.
Zusammenfassung -Sigma gegen PI Molekulare Orbitale
Ein molekulares Orbital ist eine Art von Orbital, die sich aus der Überlappung von Atomorbitalen bildet. Der Schlüsselunterschied zwischen Sigma- und PI-Molekularorbitalen besteht darin.
Referenz:
1. „Was ist ein Sigma -molekulares Orbital?” Byjus, 24. Dezember. 2020.
1. "15.3: PI Molekulare Orbitale von Benzol.” Chemie -Libretexten, Libretexten, 14. Juli 2020.
Bild mit freundlicher Genehmigung:
1. "Wasserstoffmolekül" von Chiraljon (CC von 2.0) über Flickr
2. "MO Diagramm pi Orbitale" von V8rik bei en.Wikipedia (CC BY-SA 3.0) über Commons Wikimedia