Unterschied zwischen Säure-Base-Titration und Redox-Titration
Schlüsselunterschied -Säure -Base -Titration vs. Redox -Titration
Im Allgemeinen werden Titrationen verwendet, um die Konzentration einer unbekannten Lösung zu bestimmen (Analyt). Die am häufigsten verwendeten zwei titrimetrischen Methoden sind Säure-Base-Titrationen und Redoxtitrationen. Der Schlüsselunterschied zwischen Säure-Base-Titrationen und Redoxtitrationen ist die Art der Reaktion, die zwischen dem Titrant und dem Analyten auftritt in der Titration. Bei Säure-Base-Titrationen findet eine Neutralisationsreaktion statt, und bei Redoxtitrationen findet eine Redoxreaktion statt (eine oxidierende Reaktion und eine Reduktionsreaktion). Die Verwendung von Indikatoren ist die am häufigsten verwendete Methode zur Bestimmung des Endpunkts der Reaktion.
Was ist eine Säure-Base-Titration?
In Säure-Base-Titrationen wird eine Säure (saure Titrationen) oder eine Base (Basistitrationen) als Titrant verwendet. Beispiele für Säuren, die in sauren Titrationen verwendet werden, sind H2SO4, HCL oder HNO3. Meistens gebrauchte grundlegende Titrantien sind Naoh, K2CO3 oder na2CO3. Säure-Base-Titrationen können je nach Stärke der Säure und der Base wie folgt klassifiziert werden.
- Starke Säure - starke Basentitrationen
- Starke säurwache Basentitrationen
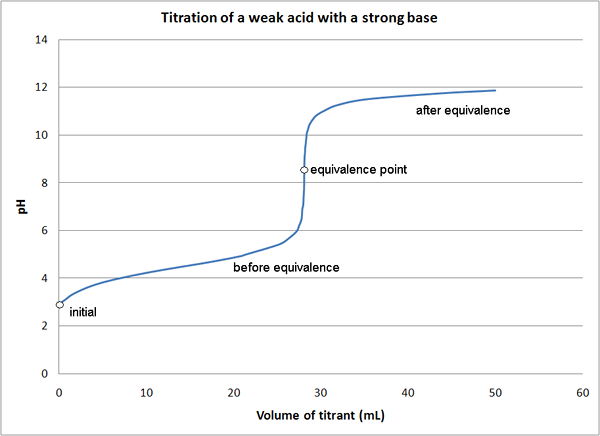
- Schwache Säure - starke Basentitrationen
- Schwache Säure - schwache Basentitrationen
In den meisten Titrationen der Säure-Base werden Indikatoren verwendet, um den Endpunkt der Reaktion zu bestimmen. Abhängig vom Typ der Titration werden verschiedene Indikatoren verwendet, wie oben erwähnt.

Was ist eine Redox -Titration?
Eine Redox -Titration beinhaltet eine Redoxreaktion. Die Redoxreaktion hat zwei Reaktionen; eine Oxidationsreaktion und eine Reduktionsreaktion. Sowohl Oxidations- als auch Reduktionsprozesse finden gleichzeitig statt, in der wir es ermöglichen, den Abschluss der Reaktion zu bestimmen. Dies ist auch als Endpunkt der Titration bekannt. Dies kann auf verschiedene Arten bestimmt werden; Unter Verwendung von Indikatorelektroden, Redox-Indikatoren (der Indikator erzeugt eine andere Farbe im Oxidationsreduzierungszustand) und Nicht-Redox-Indikatoren (Indikator erzeugt eine Farbe, wenn eine überschüssige Menge an Titranten hinzugefügt wird).

Was ist der Unterschied zwischen Säure-Base-Titration und Redox-Titration?
Art der Reaktion:
Säure-Base-Titration: Eine Säure-Base-Titration beinhaltet eine Neutralisationsreaktion zwischen dem Analyten (der Lösung mit der unbekannten Konzentration) und dem sauren oder basischen Titrant.
Redox -Titration: Eine Redoxreaktion beinhaltet eine Oxidation und eine Reduktionsreaktion zwischen dem Analyten und dem Titrant. Es gibt keine solche Regel, die Komponenten oxidiert und die sich verringert. Entweder analyt oder der titrant oxidiert und die verbleibende Komponente reduziert sich entsprechend.
Bestimmung des Endpunkts:
Säure-Base-Titration: Im Allgemeinen wird ein pH-Indikator, ein pH-Messgerät oder ein Leitfähigkeitsmesser verwendet, um den Endpunkt einer Säure-Base-Titration zu bestimmen.
Redox -Titration: Die am häufigsten verwendeten Methoden zur Bestimmung des Endpunkts einer Redoxreaktion sind ein Potentiometer oder einen Redoxindikator. Am häufigsten erzeugt der Analyte oder das Titrant am Endpunkt eine Farbe. Damit sind in diesen Fällen zusätzliche Indikatoren nicht erforderlich.
Beispiele:
Säure-Base-Titration:
| Typ | Reaktion (Indikator) |
| Starke Säure - starke Basentitration | HCl + NaOHànacl + H2O (Phenolphthalein /Methylorange) |
| Starke Säure - Schwache Basentitration | HCl + NH3à nh3Cl (Methylorange) |
| Schwache Säure - starke Basentitration | CH3Cooh + naohà ch3Coona + h2O (Phenolphthalein) |
| Schwache Säure -Weak -Basistitration | CH3COOH + NH3àch3GURREN-+NH4+(Keine geeigneten Indikatoren) |
Redox -Titration:
2 kmno4 + 5 h2C2Ö4 + 6 HCl → 2 Mncl2 + 2kcl + 10 co2 + 8 h2Ö
(+7) (+3) (+2) (+4)
In der obigen Reaktion wird Permanganat reduziert, während Oxalsäure oxidiert ist. Nach Abschluss der Reaktion ändert sich die lila Farbe von Permanganat in farblos.
Kmno4 + 5fecl2 +8HCL → 5fecl3+Mncl2+KCL+4H2Ö
(+7) (+2) (+3) (+2)
Bild mit freundlicher Genehmigung:
1. Titration von schwacher Säure mit starker Base durch Quantenkinetik (eigene Arbeit) [CC von 3.0] über Wikimedia Commons
2. "Winkler Titration Prior Titration" von Willwood [CC BY-SA 3.0] über Commons


