Unterschied zwischen Schwefelsäure und Schwefelsäure
Schlüsselunterschied - Schwefel Säure vs. Schwefelsäure
Schwefelsäure (h2SO4) und schwefelsäure (h)2SO3) sind zwei Anorganinsäuren, die Schwefel, Wasserstoff und Sauerstoff als Elemente enthalten. Der Schlüsselunterschied zwischen Schwefelsäure und schwefeler Säure ist in der Oxidationszahl von Schwefel. Darüber hinaus, wenn wir zwei Säuren in Bezug auf die Säure vergleichen, Schwefelsäure ist saurer als schwefelsäure. Mit anderen Worten, Schwefelsäure ist eine sehr starke Säure, und Schwefelsäure ist relativ schwach.
Was ist Schwefelsäure?
Schwefelsäure ist a Sehr starke dipotische Mineralsäure Das ist in jedem Verhältnis vollständig mit Wasser mischbar. Das Auflösen von Schwefelsäure in Wasser ist eine exotherme Reaktion. Es ist eine ätzende und schädliche Flüssigkeit und verursacht so viele Verletzungen wie Säureverbrennungen auf Haut oder Augen. Dies umfasst sowohl kurze als auch langfristige Effekte, abhängig von der Konzentration der Säure und der Kontaktzeit. Schwefelsäure ist aufgrund mehrerer Faktoren stark korrosiv; Säure, Oxidationsfähigkeit, Dehydratisierung, die durch konzentrierte Lösungen verursacht wird und die Wärme durch die exotherme Reaktion freigesetzt wird.

Was ist schwefelsäure?
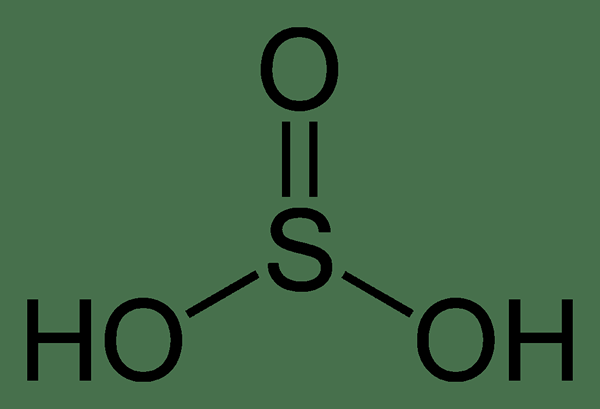
Schwefelsäure hat die chemische Formel von H2SO3, wo die Oxidationszahl von Schwefel gleich +4 ist. Es ist eine klare, farblose, schwache und instabile Säure. Es hat einen stechenden brennenden Schwefelgeruch. Es bildet sich, wenn sich Schwefeldioxid in Wasser auflöst und die reine wasserfreie Form von schwefeler Säure nie isoliert oder nachgewiesen wurde. Schwefelsäure zersetzt sich und dissoziiert schnell in seine chemischen Bestandteile; Da ist es thermodynamisch instabil. Die Zersetzungsreaktion ist,
H2SO3 (aq) → h2Ö(l) + SO2 (g)
Was ist der Unterschied zwischen Schwefelsäure und schwefeler Säure?
Struktur und chemische Formel:
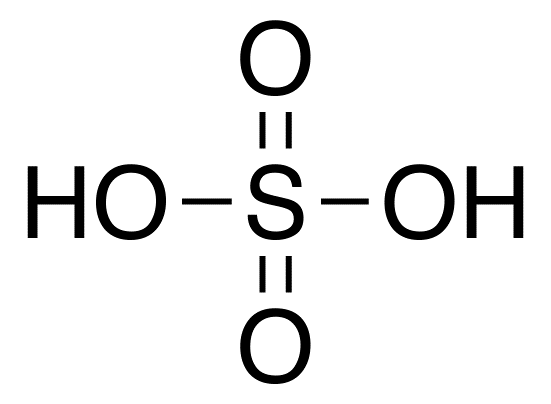
Schwefelsäure: Die chemische Formel von Schwefelsäure ist h2SO4 wo die Oxidationszahl von Schwefel +6 beträgt. Die geometrische Struktur dieses Moleküls ist tetraedrisch.
Schwefelsäure: Die chemische Formel von Schwefelsäure ist h2SO3 wo die Oxidationszahl von Schwefel +4 beträgt. Die geometrische Struktur dieses Moleküls ist trigonaler Pyramiden.
Säure:
Schwefelsäure: Schwefel ist eine der stärksten Säuren und eine diprotische Säure. Säure -Dissoziationskonstanten von Schwefelsäure sind; K1 = 2.4 × 106(starke Säure) und k2 = 1.0 × 10–2.
Schwefelsäure: Die Säure der schwefelförmigen Säure auf der pH -Skala in gleich 1.5. Es wird nicht als sehr starke Säure angesehen, aber es ist auch keine zu schwache Säure.
Eigenschaften:
Schwefelsäure: Schwefelsäure hat sowohl oxidierende als auch reduzierende Eigenschaften zusätzlich zu ihren sauren Eigenschaften. Daher reagiert es sowohl mit Metallen als auch mit Nichtmetallen; Es reagiert als andere Säuren mit Metallen, die Wasserstoffgas und das relevante Salz des Metalls erzeugen.
Reaktionen mit Metallen:
Fe (s) + h2SO4 (aq) → h2 (g) + feso4 (aq)
Cu + 2 h2SO4 → so2 + 2 h2O + so42– + Cu2+
Reaktionen mit Nicht-Metalen:
C + 2 h2SO4 → co2 + 2 Also2 + 2 h2Ö
S + 2 h2SO4 → 3 Also2 + 2 h2Ö
Schwefelsäure: Schwefelsäure existiert nicht als Lösung in wasserfreiem Schwefelsäure. Es gibt jedoch Hinweise darauf, dass in der Gasphase schwefelförmige Moleküle existieren. Im Gegensatz zu h2SO4, Schwefelsäure zeigt eine sehr begrenzte Anzahl von chemischen Reaktionen.
Caco3(S) + H2SO3(aq) → co2(G) + H2Ö(l) + Caso3(aq)
Verwendet:
Schwefelsäure: Schwefelsäure wird weltweit in einer Vielzahl von Branchen weit verbreitet verwendet. Zum Beispiel wird es verwendet, um Düngemittel, Sprengstoffe, Papiere, Waschmittel, Farbstoffe und Farbstoffmaterialien zu erzeugen. Darüber hinaus ist es für die chemische Synthese, Oberflächenbehandlungen, Erdöl- und Textileindustrie sehr wichtig.
Schwefelsäure: Schwefelsäure wird als sehr starkes Reduktionsmittel verwendet. Es hat einige Bleicheigenschaften und als Bleichmittel verwendet.
Bild mit freundlicher Genehmigung:
1. Schwefelsäurechemische Struktur durch DMACKS (eigene Arbeit) [Public Domain] über Wikimedia Commons
2. Schwefel-Säure-2D von Benjah-BMM27 (eigene Arbeit) [Public Domain] über Wikimedia Commons