Unterschied zwischen Säure und Basizität

Schlüsselunterschied - Säure gegen Basizität
Säure und Basizität von Verbindungen sind Anzeichen des pH -Werts. Die Säure eines Mediums wird durch saure Verbindungen verursacht, die Wasserstoffionen freisetzen können (H)+), was zu einem niedrigen pH -Wert in diesem Medium führt. Die Basizität eines Mediums wird durch Grundverbindungen verursacht, die Hydroxidionen freisetzen können (OH-), was zu einem hohen pH -Wert in diesem Medium führt. Der Schlüsselunterschied zwischen Säure und Basizität ist das Die Säure verursacht einen niedrigen pH -Wert, während Basizität in einem wässrigen Medium einen hohen pH -Wert verursacht.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Säure
3. Was ist Basizität
4. Seite für Seitenvergleich - Säure gegen Basizität in tabellarischer Form
5. Zusammenfassung
Was ist Säure?
Die Säure ist der Säuregehalt in Substanzen. Die Konzentration von Wasserstoffionen (H)+) ist der Hauptparameter zur Identifizierung der Säure. Die Wasserstoffionenkonzentration wird als pH -Wert ausgedrückt. pH ist der negative Logarithmus der Wasserstoffionenkonzentration. Daher höher die Wasserstoffionenkonzentration, senken Sie den pH -Wert ab. Ein niedriger pH -Wert zeigt eine höhere Säure an.
Nach der Säure von Substanzen gibt es zwei Arten von Säuren als starke Säuren und schwache Säuren. Starke Säuren verursachen ein höheres Säuregehalt in wässrigen Medium, während schwache Säuren zu einem geringen Säure führen. Starke Säuren können sich vollständig in Ionen verteilen und alle möglichen Wasserstoffionen (H) freisetzen+). Im Gegensatz dazu dissoziiert eine schwache Säure teilweise, die nur einige Wasserstoffionen freigibt. Säuren können auch als monoprotische Säuren und polyprotische Säuren kategorisiert werden; Monoprotische Säuren füllen ein Wasserstoffion pro Molekül frei, während polyprotische Säuren mehr Wasserstoffionen pro Molekül freisetzen.
Die Säure von Säuren wird durch das PKA der Säure bestimmt. PKA ist der negative Logarithmus von Ka. Ka ist die Säure -Dissoziationskonstante einer Lösung. Es ist eine quantitative Messung der Stärke einer Säure in einer Lösung (oder Säure). Senken Sie die PKA, desto stärker ist die Säure. Höher die PKA, desto schwächer ist die Säure.

Abbildung 01: Zitronensaft hat eine hohe Säure
Die periodischen Trends der Säure chemischer Elemente hängen grundsätzlich von ihren Elektronegativitätswerten ab.Die Elektronegativität chemischer Elemente steigt von links nach rechts in einem Zeitraum. Wenn die Elektronegativität eines Atoms höher ist, kann es ein negatives Atom sehr leicht stabilisieren, da es eine höhere Affinität zu Elektronen aufweist. Daher können die Wasserstoffionen, die mit hohen elektronegativen Atomen verbunden sind. Beim Eingehen einer Gruppe in der Periodenzüchter steigt die Säure an. Dies liegt daran, dass die Größe der Atome die Gruppe sinkt. Große Atome können negative Ladungen für sie stabilisieren (durch Ladungsverteilung); Daher kann ein Wasserstoffionen mit einem großen Atom leicht freigesetzt werden.
Was ist Basizität?
Basizität einer Substanz ist die Anzahl der Wasserstoffatome, die durch eine Base in einer bestimmten Säure ersetzt werden können. Mit anderen Worten, die Basizität einer Verbindung ist die Anzahl der Wasserstoffionen, die vollständig mit Hydroxidionen reagieren können, die von einer Basis freigesetzt werden.
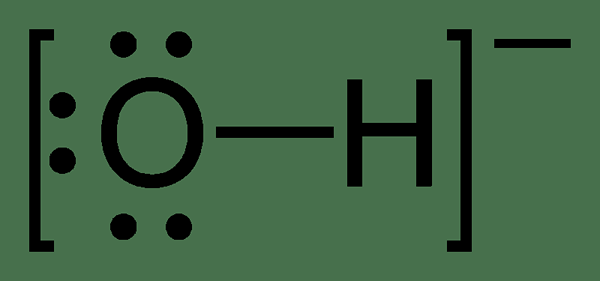
Abbildung 02: Chemische Struktur des Hydroxidionionen
Die Faktoren, die die Basizität einer Verbindung beeinflussen können, sind unten aufgeführt.
- Elektronegativität
- Atomradius
- Formelle Gebühren
Elektronegativität eines Atoms bezieht sich auf seine Affinität zu Elektronen. Ein Atom mit einer hohen Elektronegativität kann im Vergleich zu niedrigen elektronegativen Atomen Elektronen anziehen. Höher die Elektronegativität, senken Sie die Basizität senken. Um Hydroxidionen freizusetzen, sollten die Bindungselektronen zwischen dem Sauerstoffatom und dem Rest des Moleküls durch das Sauerstoffatom vollständig angezogen werden (das Sauerstoffatom in der Hydroxidgruppe sollte elektronegativer sein als das andere Atom, an das es gebunden ist). EX: Wenn die Basizität von ROH hoch ist, ist die Elektronegativität von R kleiner als die des Sauerstoffatoms.

Abbildung 03: Seifen sind schwache Basen, die durch die Reaktion von Fettsäuren mit Natriumhydroxid oder Kaliumhydroxid gebildet werden.
Der Atomradius ist ein weiterer Faktor, der die Basizität einer Verbindung beeinflusst. Wenn der Atomradius klein ist, ist die Elektronendichte dieses Atoms hoch. Daher kann das Hydroxidion leicht freigesetzt werden. Dann ist die Basizität dieser Verbindung vergleichsweise hoch.
Formale Gebühren sind im Allgemeinen entweder positive Gebühren oder negative Gebühren. Eine positive formelle Ladung zeigt eine weniger Elektronendichte an. Daher können Bindungselektronen nicht vollständig vom Hydroxidion angezogen werden. Dann kann es nicht leicht freigegeben werden (das Hydroxidion), was auf eine niedrigere Basizität hinweist. Im Gegensatz dazu führt eine negative formale Ladung eine höhere Basizität.
Was ist der Unterschied zwischen Säure und Basizität?
Säure gegen Basizität | |
| Die Säure ist der Säuregehalt in Substanzen. | Basicity bezieht sich auf den Zustand einer Basis, die Hydroxidionen freisetzen kann (OH-). |
| pH | |
| Die Säure verursacht einen niedrigen pH -Wert in wässrigen Medien. | Basizität verursacht einen hohen pH -Wert in wässrigen Medien. |
| Ionen | |
| Die Säure zeigt eine hohe Konzentration von Wasserstoffionen in einem Medium an. | Basizität zeigt eine hohe Konzentration von Hydroxidionen in einem Medium an. |
| Periodische Trends | |
| Die Säure steigt von links nach rechts und einer Gruppe hinunter von links nach rechts und hinunter. | Die Basizität nimmt von links nach rechts in einer Zeit und einer Gruppe ab. |
| Auswirkung der Elektronegativität | |
| Die Säure ist hoch, wenn die Elektronegativität (des Atoms, an das Wasserstoffatom gebunden ist) hoch ist. | Die Basizität ist hoch, wenn die Elektronegativität (des Atoms, an das das Sauerstoffatom des Hydroxidionen gebunden ist) niedrig ist. |
Zusammenfassung - Säure gegen Basizität
Säure und Basizität sind zwei grundlegende Begriffe, die in der Chemie verwendet werden. Die Säure wird durch saure Verbindungen verursacht. Basizität wird durch Grundverbindungen verursacht. Der Schlüsselunterschied zwischen Säure und Basizität besteht darin, dass Säure einen niedrigen pH -Wert verursacht, während die Basizität in einem wässrigen Medium einen hohen pH -Wert verursacht.
Referenz:
1. “7.3: strukturelle Auswirkungen auf Säure und Basizität.”Chemistry Libretexten, Libretexte, 7. September. 2016, hier erhältlich.
2. „Periodenzüchter -Trend.”Student Doctor Network, hier verfügbar.
Bild mit freundlicher Genehmigung:
1. "Lemon-edit1" von André Karwath alias AKA-eigene Arbeit (CC BY-SA 2.5) über Commons Wikimedia
2. "Hydroxid-Lone-Pair-2D" (Public Domain) über Commons Wikimedia
3. "589824" (CC0) über Pixabay


