Unterschied zwischen aktivierter Komplextheorie und Kollisionstheorie
Der Schlüsselunterschied Zwischen aktivierter komplexer Theorie und Kollisionstheorie ist das Die aktivierte Komplextheorie ist genauer und zuverlässig, wenn die Reaktionsraten beschrieben werden, während die Kollisionstheorie weniger zuverlässig ist.
Aktivitätstheoretie und Kollisionstheorie sind zwei wichtige Konzepte, die die Thermodynamik chemischer Reaktionen beschreiben. Diese Theorien können verwendet werden, um die Reaktionsraten chemischer Reaktionen vorherzusagen. Die aktivierte komplexe Theorie wird auch als als benannt Übergangszustandstheorie. Die aktivierte Komplextheorie wird jedoch als genauer angesehen als die Kollisionstheorie.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist aktivierte komplexe Theorie
3. Was ist die Kollisionstheorie
4. Seite für Seitenvergleich - aktivierte Komplextheorie gegen Kollisionstheorie in tabellarischer Form
5. Zusammenfassung
Was ist aktivierte komplexe Theorie?
Die aktivierte Komplextheorie ist eine thermodynamische Theorie, die das Vorhandensein eines Übergangszustands zwischen den Reaktanten und den Endprodukten beschreibt. Daher wird es auch als Übergangszustandstheorie benannt oder TST -Theorie. Diese Theorie liefert genauere und zuverlässigere Informationen im Vergleich zur Kollisionstheorie. Diese Theorie wurde 1935 von Henry Eyring entwickelt.
Die aktivierte Komplextheorie beschreibt die Aktivierungsenergie (EA) eines Reaktionsgemisches und die thermodynamischen Eigenschaften, die den Übergangszustand betreffen. Diese Theorie ist eine Entwicklung der Kollisionstheorie und verwendet die Grundlage der Arrhenius -Gleichung. Diese Theorie beschreibt auch den statistischen Frequenzfaktor V, der ein grundlegender Faktor dieser Theorie ist.
Nach aktivierter Komplextheorie gibt es einen Zwischenzustand zwischen dem Zustand der Reaktanten und dem Zustand der Produkte eines Reaktionsgemisches. Es wird als Übergangszustand bezeichnet, der eine aktivierte komplexe Verbindung enthält. Dieser aktivierte Komplex formen durch die Kombination von Reaktanten. Nach dieser Theorie müssen wir wichtige Tatsachen berücksichtigen, um festzustellen, ob die Reaktion auftritt. Die Fakten sind wie folgt:
- Die Konzentration des aktivierten Komplexes im Übergangszustand
- Die Rate der Aufschlüsselung dieses aktivierten Komplexes
- Der Weg der Aufschlüsselung des aktivierten Komplexes (der Komplex kann die Produkte bilden oder wieder Reaktanten bilden)
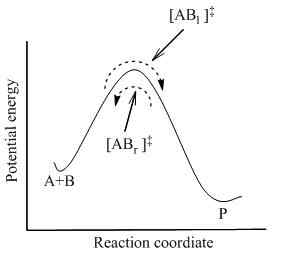
Abgesehen davon schlägt die aktivierte Komplextheorie auch das Konzept der Aktivierungsenergie in Bezug auf eine chemische Reaktion vor. Die Aktivierungsenergie ist die Energiebarriere der Reaktion; Eine gewisse Energiemenge ist wichtig, damit eine chemische Reaktion auftritt. Der aktivierte Komplex ist ein Hochenergiekomplex, der instabil ist, und hat die maximale Energie des Reaktionsprozesses. Wenn das Reaktionsgemisch eine Energiemenge erhält, die dieser Aktivierungsenergie entspricht, kann das Reaktionsgemisch die Energiebarriere überwinden und Produkte der Reaktion liefern.
Was ist die Kollisionstheorie?
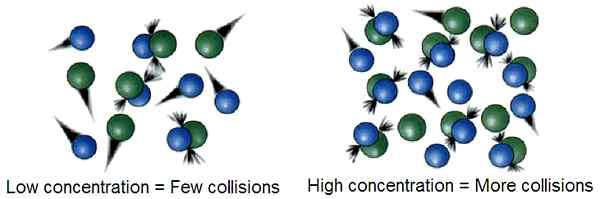
Die Kollisionstheorie ist eine thermodynamische Theorie, die das Fortschreiten einer chemischen Reaktion durch die Kollision zwischen Reaktanten zur Bildung von Produkten beschreibt. Nach dieser Theorie sind die Faktoren, die die Leichtigkeit der Kollision beeinflussen. E.G. Je mehr Energie dem Reaktionsgemisch versorgt wird, desto schneller bewegen sich die Reaktanten und kollidieren miteinander. In ähnlicher Weise können Hochtemperaturbedingungen mehr Kollisionen zwischen Reaktanten und hohen Reaktionsraten verursachen.

In der Kollisionstheorie wird die Geschwindigkeit, mit der die Reaktantenmoleküle miteinander kollidieren, als Kollisionsfrequenz genannt, z. Es gibt den Einheiten von Kollisionen pro Zeiteinheit. Nach der Kollisionstheorie beeinflusst die Energie des Reaktantengemisches und die Konzentration der Reaktanten die Reaktionsgeschwindigkeit. Damit jedoch eine erfolgreiche Kollision zwischen Reaktanten auftritt. Diese Energiemenge wird als Aktivierungsenergie bezeichnet.
Was ist der Unterschied zwischen aktivierter Komplextheorie und Kollisionstheorie?
Aktivierte Komplextheorie und Kollisionstheorie sind wichtige thermodynamische Theorien. Der Schlüsselunterschied zwischen aktivierter Komplextheorie und Kollisionstheorie besteht darin, dass die aktivierte Komplextheorie bei der Beschreibung der Reaktionsraten genauer und zuverlässig ist, während die Kollisionstheorie weniger zuverlässig ist.
Nachfolgend Infografik tabelt die Unterschiede zwischen aktivierter Komplextheorie und Kollisionstheorie genauer auf.
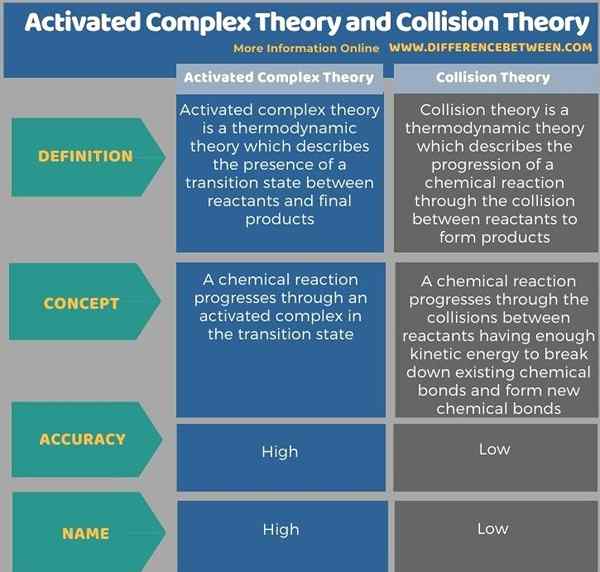
Zusammenfassung -aktivierte komplexe Theorie gegen Kollisionstheorie
Aktivierte Komplextheorie und Kollisionstheorie sind wichtige thermodynamische Theorien. Der Schlüsselunterschied zwischen aktivierter Komplextheorie und Kollisionstheorie besteht darin, dass die aktivierte Komplextheorie bei der Beschreibung der Reaktionsraten genauer und zuverlässig ist, während die Kollisionstheorie weniger zuverlässig ist.
Referenz:
1. „Aktivkomplex.” Wikipedia, Wikimedia Foundation, 18. Juni 2020, hier erhältlich.
2. „9.7: Theorien der Reaktionsraten.Chemie -Libretexten, Libretexten, 1. September. 2020, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Quasi -Equilibrium1" von Chem540grp1f08 - eigene Arbeit (Public Domain) über Commons Wikimedia
2. "Molekularkollisionen" von sadi_carnot -(öffentlichem Domäne) über Commons Wikimedia


