Unterschied zwischen Arrhenius und Eyrergleichung

Der Schlüsselunterschied Zwischen Arrhenius und Eyring -Gleichung ist das Die Arrhenius -Gleichung ist eine empirische Gleichung, während die Eyrergleichung auf der statistischen mechanischen Rechtfertigung basiert.
Arrhenius -Gleichung und Eyrergleichung sind zwei wichtige Gleichungen in der physikalischen Chemie. Wenn wir eine konstante Enthalpie der Aktivierung und konstanter Aktivierungsindetopie annehmen, ähnelt die Eyrergleichung der empirischen Arrhenius -Gleichung.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Arrhenius -Gleichung
3. Was ist Eyrergleichung
4. Seite an Seite Vergleich - Arrhenius gegen Eyrergleichung in tabellarischer Form
5. Zusammenfassung
Was ist Arrhenius -Gleichung?
Die Arrhenius -Gleichung ist eine chemische Formel, die die Temperaturabhängigkeit der Reaktionsraten beinhaltet. Diese Gleichung wurde 1889 vom Wissenschaftler Svante Arhenius vorgeschlagen und entwickelt. Die Arrhenius -Gleichung hat viele Anwendungen bei der Bestimmung der Rate chemischer Reaktionen und bei der Berechnung der Aktivierungsergie Energie. In diesem Zusammenhang bietet die Arrhenius -Gleichung eine physikalische Rechtfertigung und Interpretation für die Formel. Daher können wir es als empirische Beziehung identifizieren. Die Arrhenius -Gleichung wird wie folgt ausgedrückt:
K = ae(EA/RT)
Wobei k die Geschwindigkeitskonstante für das Reaktionsgemisch ist, T die absolute Temperatur des Systems in Kelvinen ist, A ist der vorexponentielle Faktor für die chemische Reaktion, EA die Aktivierungsenergie für die Reaktion und R die universelle Gaskonstante ist. In dieser Gleichung ist es bei Betrachtung der Einheiten des vorexponentiellen Faktors A identisch mit den Einheiten der Geschwindigkeitskonstante, die von der Reihenfolge der Reaktion abhängt. E.G. Wenn die Reaktion erster Ordnung ist, beträgt die Einheiten von a pro Sekunde (s "-1). Mit anderen Worten, in dieser Reaktion ist a die Anzahl der Kollisionen pro Sekunde, die in der richtigen Ausrichtung auftritt. Darüber hinaus beschreibt diese Beziehung, dass die Erhöhung der Temperatur oder die Verringerung der Aktivierungsenergie zur Erhöhung der Reaktionsgeschwindigkeit führt.

Abbildung 01: verschiedene Ableitungen der Arrhenius -Gleichung
Welche Eyresgleichung?
Die Eyrergleichung ist eine Gleichung, die die Änderungen der Geschwindigkeit einer chemischen Reaktion gegen die Temperatur des Reaktionsgemisches beschreibt. Diese Gleichung wurde 1935 von Henry Eyring zusammen mit zwei anderen Wissenschaftlern entwickelt. Die Eyrergleichung ähnelt der Arrhenius -Gleichung, wenn eine konstante Aktivierungserthalpie und eine konstante Aktivierungserie berücksichtigt werden. Die allgemeine Formel für die Eyrergleichung lautet wie folgt:
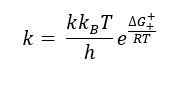
Hier ist ΔG ‡ die Gibbs -Aktivierungsergie, κ ist der Transmissionskoeffizient, KB ist Boltzmanns Konstante und H ist die Konstante von Planck.
Was ist der Unterschied zwischen Arrhenius und Eyrergleichung?
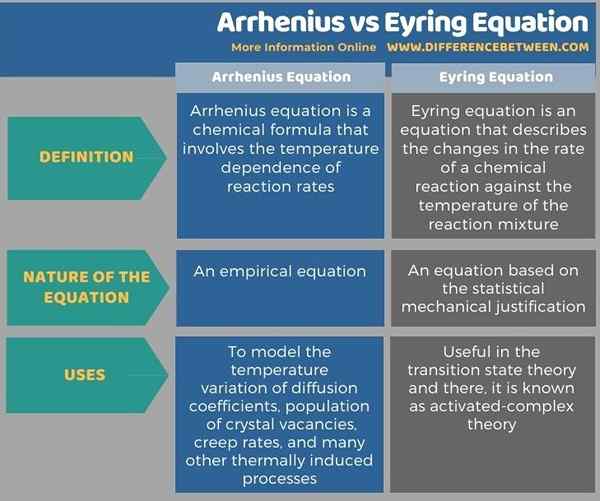
Arrhenius und Eyrergleichung sind wichtige Gleichungen in der physikalischen Chemie. Der Schlüsselunterschied zwischen Arrhenius und Eyrergleichung besteht darin, dass die Arrhenius -Gleichung eine empirische Gleichung ist, während die Eyrer -Gleichung auf der statistischen mechanischen Begründung basiert. Darüber hinaus wird die Arrhenius-Gleichung verwendet, um die Temperaturvariation von Diffusionskoeffizienten, die Population von Kristallleerstellen, Kriechraten und viele andere thermisch induzierte Prozesse zu modellieren, während die Eyrergleichung in der Übergangszustandstheorie nützlich ist und dort als aktiviert bekannt ist -Komplex -Theorie.
Nachfolgend Infografik tabuliert die Unterschiede zwischen Arrhenius und Eyrergleichung für den Nebeneinander-Vergleich.
Zusammenfassung -Arrhenius gegen Eyring -Gleichung
Arrhenius und Eyrergleichung sind wichtige Gleichungen in der physikalischen Chemie. Der Schlüsselunterschied zwischen Arrhenius und Eyrergleichung besteht darin, dass die Arrhenius -Gleichung eine empirische Gleichung ist, während die Eyrer -Gleichung auf der statistischen mechanischen Begründung basiert. Die Arrhenius-Gleichung wird verwendet, um die Temperaturvariation der Diffusionskoeffizienten, die Population von Kristallleerstellen, Kriechraten und viele andere thermisch induzierte Prozesse zu modellieren. Die Eyrergleichung hingegen ist in der Übergangszustandstheorie nützlich und ist dort als aktiviertes Komplex-Theorie bekannt.
Referenz:
1. “6.2.3.1: Arrhenius -Gleichung.Chemie -Libretexten, Libretexte, 11. September. 2020, hier erhältlich.
2. „Eyrergleichung.” Wikipedia, Wikimedia Foundation, 16. Oktober. 2020, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Arrheniusmundim New" von Kleber Carlos Mundim - eigene Arbeit (CC BY -SA 4.0) über Commons Wikimedia


