Unterschied zwischen binären Säuren und Polyatomsäuren
Der Schlüsselunterschied zwischen binären Säuren und Polyatomsäuren ist das Binärsäuren enthalten Atome aus nur zwei verschiedenen chemischen Elementen, während Polyatomsäuren Atome aus zwei oder mehr verschiedenen chemischen Elementen enthalten.
Eine Säure ist eine anorganische chemische Verbindung, die eine alkalische Substanz neutralisieren kann. Säuren können die meisten Metalle auflösen. Wir können leicht eine Säure mit Lackmuspapier identifizieren - blauer Lackmus wechselt in rote Farbe, wenn sie mit einer Säure eingeweicht werden. Es gibt verschiedene Arten von Säuren; Binärsäuren und Polyatomsäuren sind zwei solcher Typen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind Binärsäuren
3. Was sind Polyatomsäuren
4. Seite für Seitenvergleich - binäre Säuren gegen Polyatomsäuren in tabellarischer Form
5. Zusammenfassung
Was sind Binärsäuren?
Binärsäuren sind anorganische Substanzen mit Wasserstoffgebäude zu einem anderen chemischen Element. Dieses zweite chemische Element ist meistens ein nichtmetallisches Element. Der Begriff „binär“ bezieht sich auf eine Substanz mit zwei Komponenten von etwas; In diesem Zusammenhang sind es zwei verschiedene chemische Elemente. Der Säure dieser Substanzen ergibt sich aus ihrer Fähigkeit, Wasserstoff als Kation oder Proton freizusetzen, was die Säure seiner wässrigen Lösung verursacht. Die häufigsten Binärsäuren umfassen Hydrofluorsäure (HF), Salzsäure (HCl) und Hydrobromidsäure (HBR). Darüber hinaus können Binärsäuren je nach Valenz des Nichtmetalls, der an das Wasserstoffatom gebunden ist, ein oder mehrere Wasserstoffatome pro Molekül aufweisen, e.G. H2S.
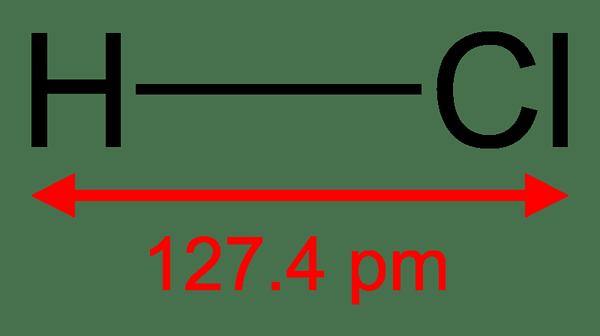
Abbildung 01: Wasserstoffchlorid
Binärsäuren können starke Säuren, schwache Säuren oder mäßig saure sein. Diese saure Stärke hängt von der Stärke der kovalenten Bindung zwischen einem Wasserstoffatom und einem nichtmetallischen Atom ab. Da alle binären Säuren Wasserstoffatome enthalten, beginnt der Name der binären Säure mit „Hydro-“.
Was sind Polyatomsäuren?
Polyatomsäuren sind anorganische Verbindungen, die Atome mit zwei oder mehr unterschiedlichen chemischen Elementen enthalten. Die Ionen, die sich aus der Dissoziation einer Polyatomsäure bilden.

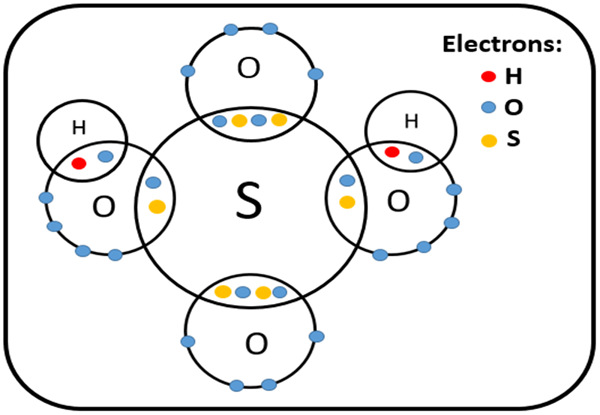
Abbildung 02: Struktur der Schwefelsäure
Einige häufige Beispiele für Polyatomsäuren sind Carbonsäure (H2CO3), Schwefelsäure (H2SO4), Schwefelsäure (H2SO3), Salpetersäure (HNO3) usw.
Was ist der Unterschied zwischen binären Säuren und Polyatomsäuren?
Eine Säure ist eine Substanz, die eine alkalische Substanz neutralisieren kann. Der Schlüsselunterschied zwischen binären Säuren und Polyatomsäuren besteht darin, dass binäre Säuren Atome aus nur zwei verschiedenen chemischen Elementen enthalten, während Polyatomsäuren Atome aus zwei oder mehr unterschiedlichen chemischen Elementen enthalten.
Darüber hinaus bilden Binärsäuren immer eine monoatomische Konjugatbase, während Polyatomsäuren eine monoatomische Konjugatbase oder eine polyatomische Base bilden können. Auch binäre Säuren sind meist starke bis mittelschwere Säuren. Hydrofluorsäure (HF), Salzsäure (HCl) und Hydrobromidsäure (HBR) sind einige Beispiele für binäre Säuren. Polyatomsäuren dagegen können starke Säuren, schwache Säuren oder mäßig saure Verbindungen sein. Einige Beispiele sind Carbonsäure (H2CO3), Schwefelsäure (H2SO4) und Salpetersäure (HNO3).
Unten infografik tabuliert die Unterschiede zwischen binären Säuren und Polyatomsäuren nebeneinander.
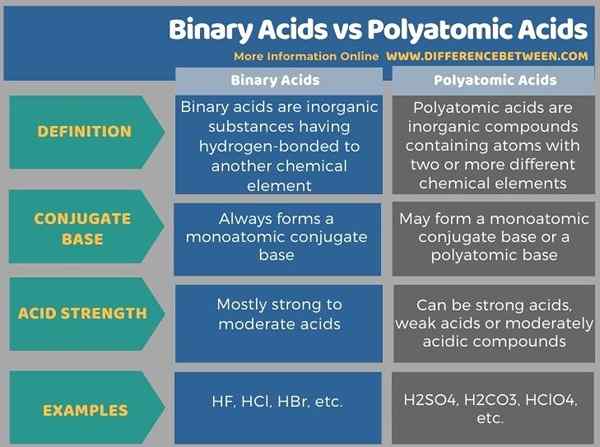
Zusammenfassung -binäre Säuren gegen Polyatomsäuren
Wir können Säuren mit Lackmustapern leicht identifizieren. Blue Lackmus wird rot, wenn es mit einer Säure getränkt ist. Es gibt verschiedene Arten von Säuren, wie Binärsäuren und Polyatomsäuren. Der Schlüsselunterschied zwischen binären Säuren und Polyatomsäuren besteht darin, dass binäre Säuren Atome aus nur zwei verschiedenen chemischen Elementen enthalten, während Polyatomsäuren Atome aus zwei oder mehr unterschiedlichen chemischen Elementen enthalten.
Referenz:
1. Helmenstine, Anne Marie. „Was sind Säuren und Basen?”Thoughtco, August. 26, 2020, hier erhältlich.
2. „5.9: Säuren benennen.”Chemie libretexten, libretexten, 20. November. 2020, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Wasserstoffchlorid-2D-Dimensionen" (Public Domain) über Commons Wikimedia
2. "H2SO4 PIC" von Jadder1224 - eigene Arbeit (CC BY -SA 4.0) über Commons Wikimedia


