Unterschied zwischen Bindungsenthalpie und Gitterenthalpie
Der Schlüsselunterschied Zwischen Bondenthalpie und Gitterenthalpie ist das Die Bindungsenthalpie ist die Energiemenge, die erforderlich ist, um eine chemische Bindung abzubauen, während die Gitterenergie die Energiemenge ist, die erforderlich ist, um einen Mol einer ionischen Verbindung aus den Kationen und Anionen im gasösen Zustand zu bilden.
Beide Begriffe beschreiben den Energieaustausch zwischen einem System und seiner Umgebung. Bondenthalpie ist das Gegenteil der Gitterenthalpie. Bondenthalpie erklärt das Bond -Brechen, während Gitterenthalpie die Bindungsbildung erklärt. Deshalb sind sie entgegengesetzte Phänomene zueinander.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Bondenthalpie
3. Was ist Gitterenthalpie
4. Seite für Seitenvergleich - Bondenthalpie gegen Gitterenthalpie in tabellarischer Form
5. Zusammenfassung
Was ist Bondenthalpie?
Anleiheenthalpie ist die Energiemenge, die erforderlich ist, um eine chemische Bindung abzubauen. Wenn wir hier die Standarddefinition anwenden, heißt es, dass die Bondenthalpie die Enthalpieänderung ist, wenn ein Mol Bindungen bei 298 K in einer Substanz unterbrochen wird. Da dieser Begriff sich mit Bond Break befasst, können wir ihn auch als Dissoziationsenergie für Anleihen nennen. Andere Synonyme sind Bindungsstärke und durchschnittliche Bindungsenergie.

Abbildung 01: Bindungsenergien einiger chemischer Bindungen
Wenn der Wert der Bindungsenthalpie hoch ist, bedeutet dies, dass die Bindung sehr stark und schwer zu zerstören ist. Daher erfordert es mehr Energie, um diese bestimmte Bindung abzubauen. Typischerweise sind die Einheiten, die wir für die Bestimmung des Wertes für Bindungsenthalpie verwenden, kcal/mol (Kilokalorien pro Mole) oder KJ/Mol (Kilojoule pro Mole).
Was ist Gitterenthalpie?
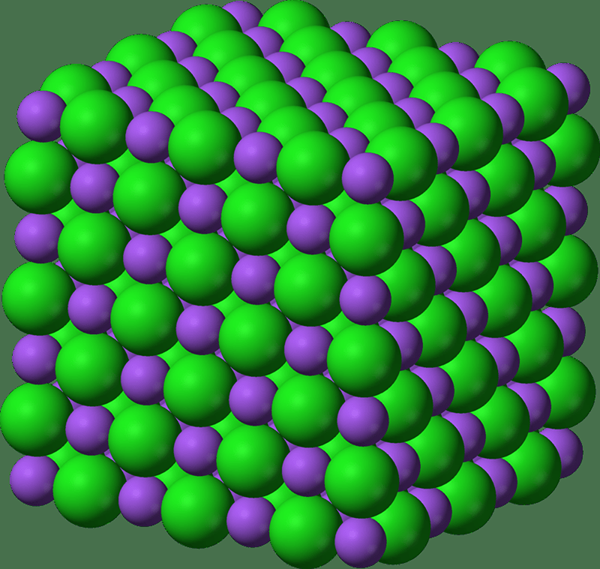
Gitterenthalpie ist die Energiemenge, die erforderlich ist, um ein Mol einer ionischen Verbindung unter Standardbedingungen zu bilden, unter Verwendung der Kationen und Anionen im gasförmigen Zustand. Da wir hier mit Kristallgitter zu tun haben, wird der Begriff Gitterenthalpie für Kristallgitter verwendet. Mit anderen Worten, es wird für feste Verbindungen angewendet. Es ist ein Maß für die Kräfte, die die Ionen zusammenbinden (die kohäsiven Kräfte).

Abbildung 02: Eine Gitterstruktur
Im Allgemeinen ist Gitterenergie für die Bestimmung einiger physikalischer Eigenschaften wichtig, einschließlich Löslichkeit von Kristallen, Härte und Volatilität. In der Regel ist Gitterenergie eine negative Energie, aber Gitterenthalpie ist ein positiver Wert. Dies liegt daran, dass das Volumen eines Mol des kristallinen Feststoffs bei der Bildung des Gitters abnimmt.
Was ist der Unterschied zwischen Bindungsenthalpie und Gitterenthalpie?
Anleiheenthalpie ist der Prozess gegenüber der Gitterenthalpie, da die Bond -Enthalpie mit Bond Breaking während der Gitterenthalpie mit Bondsforming befasst. Daher besteht der Hauptunterschied zwischen Bindungsenthalpie und Gitterenthalpie darin, dass die Bindungsenthalpie die Energiemenge ist, die erforderlich ist Kationen und Anionen im gasförmigen Zustand. Bondenthalpie ist die Enthalpieänderung, wenn ein Mol Bindungen in einer Substanz bei 298 K gebrochen wird. Daher können wir es auch als Bindungsdissoziationenthalpie bezeichnen.
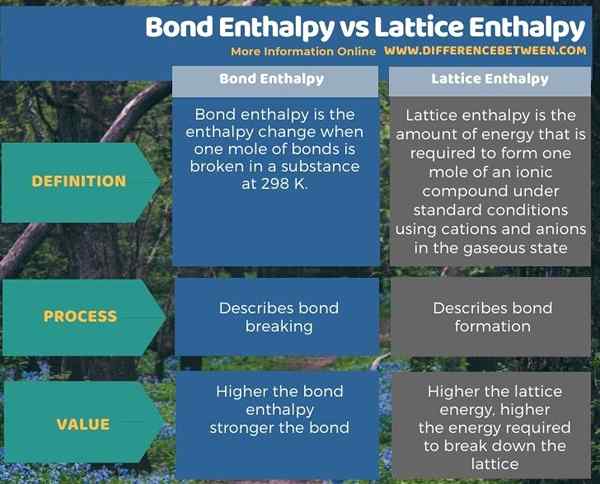
Zusammenfassung -Anleiheenthalpie gegen Gitterenthalpie
Anleiheenthalpie befasst sich mit Bond Breaking, während Gitterenthalpie sich mit der Anleiheformung befasst. Daher besteht der Hauptunterschied zwischen Bindungsenthalpie und Gitterenthalpie darin, dass die Bindungsenthalpie die Energiemenge ist, die erforderlich ist Kationen und Anionen im gasförmigen Zustand.
Referenz:
1. Helmenstine, Anne Marie. „Definition der Bindungsenthalpie in der Chemie.”Thoughtco, August. 8, 2019, hier erhältlich.
2. „Bindungsenergie.Wikipedia, Wikimedia Foundation, 4. November. 2019, hier erhältlich.
3. „Gitterenergie.Wikipedia, Wikimedia Foundation, 11. November. 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Bond Energies" von Chem540f09grp8 - eigene Arbeit (Public Domain) über Commons Wikimedia
2. "Natrium-Chlorid-3D-Ionic" von Benjah-BMM27 (Talk · Beiträge)-eigene Arbeit (Public Domain) über Commons Wikimedia


