Unterschied zwischen Chromat und Dichromat

Der Schlüsselunterschied Zwischen Chromat und Dichromat ist das Chromat erscheint in leuchtend gelber Farbe, während Dichromat in hell orange Farbe auftritt.
Chromat und Dichromat sind Anionen, die Chrom- und Sauerstoffatome enthalten. Daher sind sie Oxyanionen von Chrom. Wir verwenden diese Begriffe häufig als allgemeine Begriffe, um die Verbindungen mit diesen Anionen zu benennen. Diese beiden Anionen haben eng ähnliche chemische Strukturen; Chromat hat ein Chromatanion, während Dichromat zwei Chromatanionen in Kombination miteinander hat. Aber sie haben unterschiedliche Erscheinungen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Chromat
3. Was ist Dichromat
4. Seite an Seitenvergleich - Chromat gegen Dichromat in tabellarischer Form
5. Zusammenfassung
Was ist Chromat?
Chromat ist ein Oxyanion von Chrom mit der chemischen Formel -CRO42-. Im Allgemeinen verwenden wir diesen Begriff, um die Verbindungen zu benennen, die dieses Anion gemeinsam als eine Gruppe enthalten, ich.e. Verbindungen, die das Chromatanion enthalten, werden als Chromate bezeichnet. Normalerweise haben die Chromate eine leuchtend gelbe Farbe. Das Chromatom in diesem Anion befindet sich im +6 Oxidationszustand. Es ist ein mäßig starker Oxidationsmittel. Die Molmasse dieses Anion beträgt 115.99 g/mol.
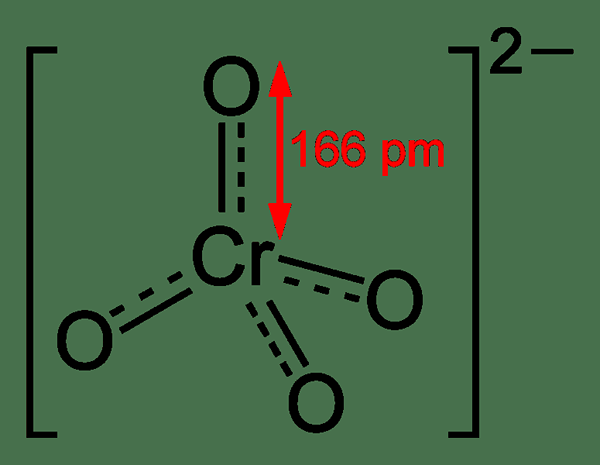
Abbildung 01: Chemische Struktur des Chromationionen
Bei der Betrachtung der Eigenschaften und Reaktionen von Chromaten können sie mit Wasserstoffperoxid reagieren, da das Peroxidanion ein oder mehrere Sauerstoffatome ersetzt. In einer wässrigen Lösung gibt es normalerweise ein Gleichgewicht zwischen Chromat und Dichromat. Wir können jedoch bei hohen pH -Werten eine hohe Menge an Chromat finden (höher als 6.5 pH) wo die Dichromenmenge sehr klein ist. Dies bedeutet, dass in alkalischen Lösungen die vorherrschende Spezies Chromat ist.
Was ist Dichromat?
Dichromat ist ein Oxyanion von Chrom mit der chemischen Formel -Cr -Cr -Cromion2Ö72-. Normalerweise verwenden wir diesen Begriff, um die Verbindungen zu benennen, die dieses Anion gemeinsam als eine Gruppe enthalten. Für e.G., Kaliumdichromat, Natriumdichromat sind Dichromate. Darüber hinaus zeigen die Verbindungen, die Dichromat als Anion enthalten. Die Molmasse dieses Anion beträgt 215.99 g/mol. Bei der Betrachtung der Geometrie von Dichromat hat es eine tetraedrische Geometrie um das Chromatom.

Abbildung 02: Auftreten von Dichromat -Verbindungen
In einer wässrigen Lösung gibt es normalerweise ein Gleichgewicht zwischen Chromat und Dichromat. Wir können jedoch bei niedrigen pH -Werten eine hohe Menge an Dichromat und eine sehr kleine Menge Chromat finden (niedriger als 6.5 pH).
Was ist der Unterschied zwischen Chromat und Dichromat?
Chromat und Dichromat sind Anionen, die Chrom- und Sauerstoffatome enthalten. Daher sind sie Oxyanionen von Chrom. Der Schlüsselunterschied zwischen Chromat und Dichromat besteht darin. Darüber hinaus hat Chromation ein Chromatom pro Anion, während Dichromation zwei Chromatome pro Anion aufweist.
Außerdem liegt ein weiterer Unterschied zwischen Chromat und Dichromat in ihrer Molmasse. Die Molmasse von Dichromat Anion beträgt 215.99 g/mol, während die Molmasse des Chromatanion 115 beträgt.99 g/mol. In einer wässrigen Lösung gibt es normalerweise ein Gleichgewicht zwischen Chromat und Dichromat. Wir können jedoch bei hohen pH -Werten eine hohe Menge an Chromat finden (höher als 6.5 pH) wo die Dichromenmenge sehr klein ist. Aber bei niedrigen pH -Werten (niedriger als 6.5 pH) Es gibt mehr Dichromationen.

Zusammenfassung -Chromat gegen Dichromat
Chromat und Dichromat sind Anionen, die Chrom- und Sauerstoffatome enthalten. Daher sind sie Oxyanionen von Chrom. Der Schlüsselunterschied zwischen Chromat und Dichromat besteht darin, dass Chromat in einer leuchtend gelben Farbe auftritt. In einer wässrigen Lösung gibt es normalerweise ein Gleichgewicht zwischen Chromat und Dichromat. Wir können jedoch bei hohen pH -Werten eine hohe Menge an Chromat finden (höher als 6.5 pH), während in niedrigen pH -Werten (niedriger als 6.5 pH) Es gibt mehr Dichromationen.
Referenz:
1.„Dichromat.Nationales Zentrum für Biotechnologieinformationen. Pubchem Compound -Datenbank, u.S. National Library of Medicine, hier verfügbar.
2."Kaliumdichromat.Wikipedia, Wikimedia Foundation, 9. November. 2019, hier erhältlich.
3. Cheremisinoff, Paul N. „Behandlung des Abwasserdünger -Industrie -Beispiels.”Abfallminimierung und Kostensenkung für die Prozessindustrie, 1995, PP. 285-324., doi: 10.1016/B978-081551388-9.50010-5.
Bild mit freundlicher Genehmigung:
1. "Chromat-2D-Dimensionen" von Ben Mills-eigene Arbeit (Public Domain) über Commons Wikimedia
2. "Kalium-Dichromat-Sample" von Benjah-BMM27-eigene Arbeit (Public Domain) über Commons Wikimedia


