Unterschied zwischen kolligativen Eigenschaften von Elektrolyten und Nichtelektrolyten
Schlüsselunterschied - Kolligativ Eigenschaften von Elektrolyten gegenüber Nichtelektrolyten
Kolligative Eigenschaften sind physikalische Eigenschaften einer Lösung, die von der Menge eines gelösten Stoffes abhängt, aber nicht von der Art des gelösten Stoffes. Dies bedeutet, dass ähnliche Mengen von völlig unterschiedlichen gelösten gelösten diese physikalischen Eigenschaften in ähnlichen Mengen verändern können. Daher hängen die kolligativen Eigenschaften vom Verhältnis des gelösten Betrags und des Lösungsmittelbetrags ab. Die drei wichtigsten kolligativen Eigenschaften sind Dampfdruckabsenkung, Siedepunkthöhe und Gefrierpunktdepression. Für ein gegebenes Massenverhältnis von gelösten Lösungsmitteln sind alle kolligativen Eigenschaften umgekehrt proportional zur Molmasse gelöst. Elektrolyte sind Substanzen, die Lösungen bilden können, die in der Lage sind, Elektrizität durch diese Lösung zu leisten. Solche Lösungen werden als elektrolytische Lösungen bezeichnet. Nichtelektrolyten sind Substanzen, die nicht in der Lage sind, elektrolytische Lösungen zu bilden. Beide Typen (Elektrolyte und Nichtelektrolyte) haben kolligative Eigenschaften. Der Schlüsselunterschied Zwischen kolligativen Eigenschaften von Elektrolyten und Nichtelektrolyten ist das, dass Die Wirkung von Elektrolyten auf kolligative Eigenschaften ist im Vergleich zu den Nichtelektrolyten sehr hoch.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind kolligative Eigenschaften von Elektrolyten
3. Was sind kolligative Eigenschaften von Nichtelektrolyten
4. Seite für Seitenvergleich - Kolligative Eigenschaften von Elektrolyten gegenüber Nichtelektrolyten in tabellarischer Form
5. Zusammenfassung
Was sind kolligative Eigenschaften von Elektrolyten?
Kolligative Eigenschaften von Elektrolyten sind die physikalischen Eigenschaften elektrolytischer Lösungen, die von der Menge der gelösten gelösten Stoffe abhängen, unabhängig von der Art von gelösten Stoffen. Die in elektrolytischen Lösungen vorhandenen gelösten Stoffe sind Atome, Moleküle oder Ionen, die entweder verloren oder Elektronen gewonnen haben, um elektrisch leitend zu werden.
Wenn ein Elektrolyt in einem Lösungsmittel wie Wasser gelöst wird, trennt sich der Elektrolyt in Ionen (oder andere leitende Spezies). Daher liefert das Auflösen eines Elektrolytenmols immer zwei oder mehr Mol leitfähige Arten. Daher ändern sich die kolligativen Eigenschaften der Elektrolyte erheblich, wenn ein Elektrolyt in einem Lösungsmittel gelöst wird.
Beispielsweise ist die allgemeine Gleichung, die bei der Beschreibung von Gefrierpunkt- und Siedepunktänderungen verwendet wird,
ΔtB = KBM und ΔtF = KFM
ΔtB ist eine Erhöhung der Siedepunkt und ΔTF ist Gefrierpunktdepression. KB und kF sind Konstante der Siedepunkthöhe und Gefrierpunkt -Depressionskonstante jeweils. M ist die Molarität der Lösung. Für elektrolytische Lösungen werden die obigen Gleichungen wie folgt modifiziert,
ΔtB = ich kBM und δtF = ich kFM
"I" ist ein Ionenmultiplikator, der als Van't Hoff -Faktor bekannt ist. Dieser Faktor entspricht der Anzahl der Mol von Ionen, die durch einen Elektrolyten gegeben werden. Daher kann Van't Hoff -Faktor bestimmt werden, indem die Anzahl der von einem Elektrolyten freigegebenen Ionen festgestellt wird, wenn er in einem Lösungsmittel gelöst ist. Zum Beispiel beträgt der Wert von Van't Hoff -Faktor für NaCl 2 und in CACL2, Es ist 3.

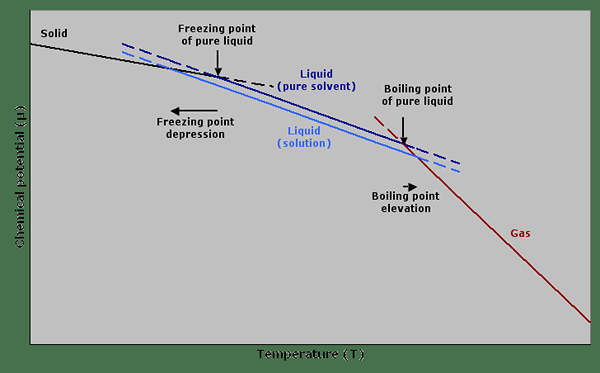
Abbildung 01: Ein Diagramm, das das chemische Potential gegen Temperatur zeigt
Die für diese kolligativen Eigenschaften angegebenen Werte unterscheiden sich jedoch von den theoretisch vorhergesagten Werten. Das liegt daran.
Die obigen Gleichungen werden weiter modifiziert, um für schwache Elektrolyte verwendet zu werden. Die schwachen Elektrolyte diskutieren sich teilweise in Ionen, daher beeinflussen einige Ionen die kolligativen Eigenschaften nicht. Der Grad der Dissoziation (α) eines schwachen Elektrolyten kann wie folgt berechnet werden,
α = (i-1)/(n-1) x 100
Hier ist n die maximale Anzahl von Ionen, die pro Molekül des schwachen Elektrolyten gebildet werden.
Was sind kolligative Eigenschaften von Nichtelektrolyten?
Kolligative Eigenschaften von Nichtelektrolyten sind die physikalischen Eigenschaften nichtelektrolytischer Lösungen, die von der Menge der gelösten gelösten Stoffe abhängen. Nicht-Elektrolyte sind Substanzen, die keine leitenden Lösungen erzeugen, wenn sie in einem Lösungsmittel gelöst werden. Zum Beispiel ist Zucker ein Nichtelektrolyt, da der Zucker in Wasser in molekularer Form existiert (nicht in Ionen dissoziiert). Diese Zuckermoleküle sind nicht in der Lage, elektrische Ströme durch die Lösung durchzuführen.
Die Anzahl der in einer nicht-elektrolytischen Lösung vorhandenen gelösten gelösten gelösten lösung ist im Vergleich zu einer elektrolytischen Lösung geringer. Daher ist die Wirkung von Nichtelektrolyten auf die kolligativen Eigenschaften ebenfalls sehr niedrig. Beispielsweise ist der Grad der Dampfdruckabsenkung durch Zugabe von NaCl im Vergleich zu Zucker zu einer ähnlichen Lösung höher.
Was ist der Unterschied zwischen kolligativen Eigenschaften von Elektrolyten und Nichtelektrolyten?
Kolligative Eigenschaften von Elektrolyten gegenüber Nichtelektrolyten | |
| Kolligative Eigenschaften von Elektrolyten sind die physikalischen Eigenschaften elektrolytischer Lösungen, die von der Menge der gelösten gelösten Stoffe abhängen, unabhängig von der Art von gelösten Stoffen. | Kolligative Eigenschaften von Nichtelektrolyten sind die physikalischen Eigenschaften nichtelektrolytischer Lösungen, die von der Menge der gelösten gelösten Stoffe abhängen. |
| Gelöste Stoffe | |
| Elektrolyte liefern durch Dissoziation mehr gelöste Stoffe zur Lösung; Daher werden die kolligativen Eigenschaften erheblich verändert. | Nichtelektrolyte liefern einen geringen gelösten Stoff für die Lösung, da keine Dissoziation vorliegt. Daher werden die kolligativen Eigenschaften nicht wesentlich verändert. |
| Auswirkung auf kolligative Eigenschaften | |
| Die Wirkung von Elektrolyten auf kolligative Eigenschaften ist im Vergleich zu Nichtelektrolyten sehr hoch. | Die Wirkung von Nichtelektrolyten auf die kolligativen Eigenschaften ist im Vergleich zu Elektrolyten sehr niedrig. |
Zusammenfassung - Kolligativ Eigenschaften von Elektrolyten gegenüber Nichtelektrolyten
Kolligative Eigenschaften sind physikalische Eigenschaften von Lösungen, die nicht von der Art eines gelösten Stoffes abhängen, sondern von der Menge an gelösten Stoffen. Der Unterschied zwischen kolligativen Eigenschaften von Elektrolyten und Nichtelektrolyten besteht darin, dass die Wirkung von Elektrolyten auf kolligative Eigenschaften im Vergleich zu Nichtelektrolyten sehr hoch ist.
Referenz:
1.„5.9: Kolligative Eigenschaften von Elektrolytlösungen.”Chemistry Libretexten, Libretexte, 21. Juli 2016. Hier verfügbar
2."Kolligative Eigenschaften.”Wikipedia, Wikimedia Foundation, 10. März. 2018. Hier verfügbar
3.Britannica, die Herausgeber von Encyclopaedia. "Elektrolyt.”Encyclopædia Britannica, Encyclopædia Britannica, Inc., 7. Juni 2017. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.'Gefrierpunkt -Depression und Siedepunkt Höhe von Tomas er - eigene Arbeit (CC BY -SA 3).0) über Commons Wikimedia


