Unterschied zwischen Kollisionstheorie und Übergangszustandstheorie
Schlüsselunterschied - Kollision Theorie vs Übergangszustandstheorie
Kollisionstheorie und Übergangszustandstheorie sind zwei Theorien, die zur Erklärung der Reaktionsraten verschiedener chemischer Reaktionen auf molekularer Ebene verwendet werden. Die Kollisionstheorie beschreibt die Kollisionen von Gasmolekülen bei chemischen Reaktionen in Gasphasen. Die Theorie des Übergangszustands erklärt die Reaktionsraten durch Annahme der Bildung von Zwischenverbindungen, die Übergangszustände sind. Der Schlüsselunterschied Zwischen Kollisionstheorie und Übergangszustandstheorie ist das Die Kollisionstheorie bezieht sich auf die Kollisionen zwischen Gasmolekülen, während der Übergangszustandstheorie sich auf die Bildung von Zwischenverbindungen in Übergangszuständen bezieht.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist die Kollisionstheorie
3. Was ist Übergangszustandstheorie
4. Seite an Seitenvergleich - Kollisionstheorie gegen Übergangszustandstheorie in tabellarischer Form
5. Zusammenfassung
Was ist die Kollisionstheorie?
Die Kollisionstheorie erklärt, dass chemische Reaktionen von Gasphasen auftreten, wenn Moleküle mit ausreichender kinetischer Energie kollidieren. Diese Theorie basiert auf der kinetischen Theorie von Gasen (die kinetische Theorie von Gasen beschreibt, dass Gase Partikel mit keinen definierten Volumina enthalten, aber mit definierten Massen und es gibt keine intermolekularen Anziehungen oder Abstoßungen zwischen diesen Gaspartikeln).

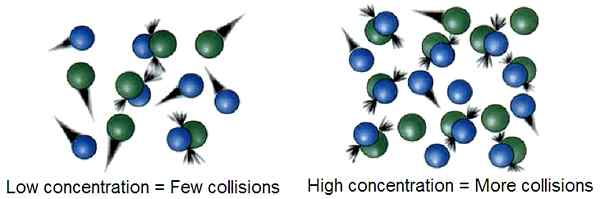
Abbildung 01: Wenn sich viele Gaspartikel in einem kleinen Volumen befinden, ist die Konzentration hoch, dann ist die Wahrscheinlichkeit, zwei Gaspartikel zu kollidieren. Dies führt zu einer hohen Anzahl erfolgreicher Kollisionen
Gemäß der Kollisionstheorie führen nur wenige Kollisionen zwischen Gaspartikeln dazu, dass diese Partikel beträchtliche chemische Reaktionen unterzogen werden. Diese Kollisionen werden als erfolgreiche Kollisionen bezeichnet. Die für diese erfolgreiche Kollision erforderliche Energie wird als Aktivierungsenergie bezeichnet. Diese Kollisionen können Bruch und Bildung chemischer Bindungen verursachen.
Was ist Übergangszustandstheorie?
Die Theorie des Übergangszustands zeigt, dass zwischen dem Zustand, in dem Moleküle Reaktanten sind, und in dem Zustand, in dem Moleküle Produkte sind. Die Übergangszustandstheorie kann verwendet werden, um die Reaktionsraten von Elementarreaktionen zu bestimmen. Nach dieser Theorie befinden sich die Reaktanten, Produkte und Übergangszustandsverbindungen im chemischen Gleichgewicht miteinander.
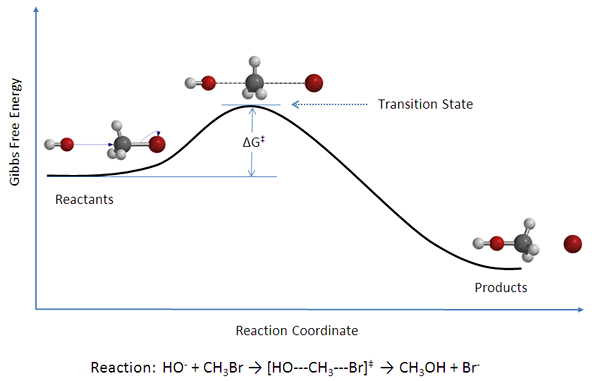
Abbildung 02: Ein Diagramm mit Reaktanten, Produkten und Übergangszustandskomplexen
Die Übergangszustandstheorie kann verwendet werden, um den Mechanismus einer elementaren chemischen Reaktion zu verstehen. Diese Theorie ist eine genauere Alternative zur Arrhenius -Gleichung. Nach der Theorie des Übergangszustands gibt es drei Hauptfaktoren, die den Mechanismus einer Reaktion beeinflussen;
- Die Konzentration der Übergangszustandsverbindung (bekannt als aktivierter Komplex)
- Die Rate der Aufschlüsselung des aktivierten Komplexes - Dies bestimmt die Rate der Bildung des gewünschten Produkts
- Der Weg der Ausbreitung des aktivierten Komplexes - Dies bestimmt die Produkte, die in der chemischen Reaktion gebildet werden
Nach dieser Theorie gibt es jedoch zwei Ansätze für eine chemische Reaktion; Der aktivierte Komplex kann in die Reaktantform zurückkehren oder sich ausbrechen, um Produkte zu bilden. Die Energiedifferenz zwischen Reaktantergie und Übergangszustandsenergie wird als Aktivierungsenergie bezeichnet.
Was ist der Unterschied zwischen Kollisionstheorie und Übergangszustandstheorie?
Kollisionstheorie gegen Übergangszustandstheorie | |
| Die Kollisionstheorie erklärt, dass die chemischen Reaktionen der Gasphasen auftreten, wenn Moleküle mit ausreichender kinetischer Energie kollidieren. | Die Theorie des Übergangszustands zeigt, dass zwischen dem Zustand, in dem Moleküle Reaktanten sind, und in dem Zustand, in dem Moleküle Produkte sind. |
| Prinzip | |
| Die Kollisionstheorie besagt, dass chemische Reaktionen (in der Gasphase) aufgrund von Kollisionen zwischen Reaktanten auftreten. | Die Theorie des Übergangszustands besagt, dass chemische Reaktionen durch Durchlaufen eines Übergangszustands auftreten. |
| Anforderungen | |
| Nach der Kollisionstheorie führen nur erfolgreiche Kollisionen zu chemischen Reaktionen auf. | Nach der Theorie des Übergangszustands wird eine chemische Reaktion fortschreiten, wenn die Reaktanten die Aktivierungsenergiebarriere überwinden können. |
Zusammenfassung -Kollision Theorie vs Übergangszustandstheorie
Kollisionstheorie und Übergangszustandstheorie werden verwendet, um die Reaktionsraten und Mechanismen verschiedener chemischer Reaktionen zu erklären. Der Unterschied zwischen Kollisionstheorie und Übergangszustandstheorie besteht darin, dass sich die Kollisionstheorie auf die Kollisionen zwischen Gasmolekülen bezieht, während der Übergangszustandstheorie die Bildung von Zwischenverbindungen in Übergangszuständen bezieht.
Referenz:
1.„Kollisionstheorie.”Chemistry Libretexten, Libretexte, 22. Mai 2017. Hier verfügbar
2.„Übergangszustandstheorie.”Wikipedia, Wikimedia Foundation, 28. Februar. 2018. Hier verfügbar
3.„9.7: Theorien der Reaktionsraten.”Chemistry Libretexten, Libretexte, 21. Juli 2016. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.'Molekularkollisions'by sadi_carnot (öffentlich-domäne) über Commons Wikimedia
2.'RXN -Koordinatendiagramm 5'By Chem540grp1f08 - eigene Arbeit, (CC BY -SA 3.0) über Commons Wikimedia


