Unterschied zwischen Konzentrationszellen und chemischer Zelle
Der Schlüsselunterschied zwischen Konzentrationszellen und chemischer Zelle ist das, In Konzentrationszellen sind die Zusammensetzungen von zwei Halbzellen ähnlich, während in den chemischen Zellen die Zusammensetzungen ähnlich sind oder nicht ähnlich sind oder nicht ähnlich sind.
Konzentrationszelle ist eine Art elektrochemischer Zelle. Es gibt zwei Arten von elektrochemischen Zellen oder chemischen Zellen als galvanische Zellen und elektrolytische Zellen. Die Konzentrationszelle ist eine Art galvanische Zelle.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist eine Konzentrationszelle
3. Was ist eine chemische Zelle
4. Seite für Seitenvergleich - Konzentrationszelle gegen chemische Zelle in tabellarischer Form
5. Zusammenfassung
Was ist eine Konzentrationszelle?
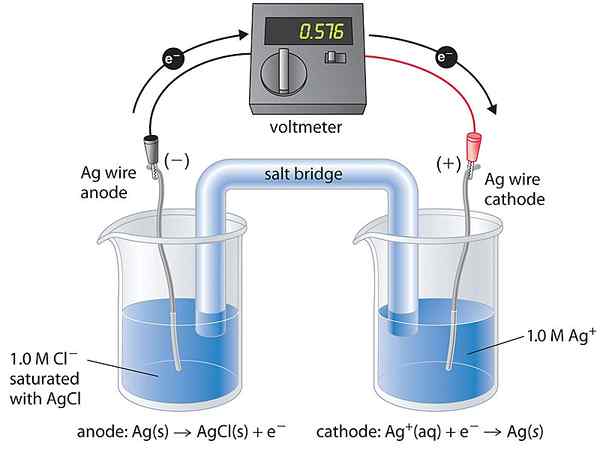
Die Konzentrationszelle ist eine Art galvanische Zelle, in der die beiden Halbzellen der Zelle in der Zusammensetzung ähnlich sind. Daher sagen wir, die beiden Halbzellen sind gleichwertig. Sie unterscheiden sich nur in der Konzentration. Die von dieser Zelle erzeugte Spannung ist sehr gering, da diese Zelle dazu neigt, einen Gleichgewichtszustand zu erhalten. Das Gleichgewicht kommt, wenn die Konzentrationen der beiden Halbzellen gleich werden.

Die Konzentrationszelle erzeugt Strom durch die Verringerung der thermodynamischen freien Energie des Systems. Da die Zusammensetzung der Halbzellen ähnlich ist, tritt die gleiche Reaktion auf, jedoch in entgegengesetzte Richtungen. Dieser Prozess erhöht also die Konzentration der niedrigeren Konzentrationszelle und verringert die Konzentration der höheren Konzentrationszelle. Wenn der Strom fließt, wird thermische Energie erzeugt. Die Zelle absorbiert diese Energie als Wärme. Es gibt zwei Arten von Konzentrationszellen wie folgt:
- Elektrolytkonzentrationszelle - Die Elektroden bestehen aus derselben Substanz, und die Halbzellen enthalten den gleichen Elektrolyten mit unterschiedlichen Konzentrationen
- Elektrodenkonzentrationszelle - Zwei Elektroden (gleicher Substanz) unterschiedlicher Konzentrationen werden in denselben Elektrolyten getaucht
Was ist eine chemische Zelle
Eine chemische Zelle, genauer gesagt eine elektrochemische Zelle, ist ein System (ein Gerät), das durch spontane chemische Reaktionen elektrische Energie erzeugen kann. Die chemischen Reaktionen, die an diesem Prozess beteiligt sind, werden als Redoxreaktionen bezeichnet. Diese Reaktionen treten durch die Übertragung von Elektronen zwischen chemischen Spezies auf. Darüber hinaus hat eine Redoxreaktion zwei Halbreaktionen, die als Oxidationsreaktion und Reduktionsreaktion bekannt sind. Während Oxidationsreaktionen immer Elektronen für das System freisetzen, nehmen Reduktionsreaktionen Elektronen aus dem System. So können wir sagen, dass die beiden Halbreaktionen gleichzeitig auftreten.
Es gibt zwei Arten von elektrochemischen Zellen als Voltaik- (galvanische) Zellen und elektrolytische Zellen. Eine elektrochemische Zelle besteht aus zwei Halbzellen. Die Halbreaktionen treten in diesen beiden Halbzellen auf. Darüber hinaus verursachen die chemischen Reaktionen, die in einer Zelle stattfinden.
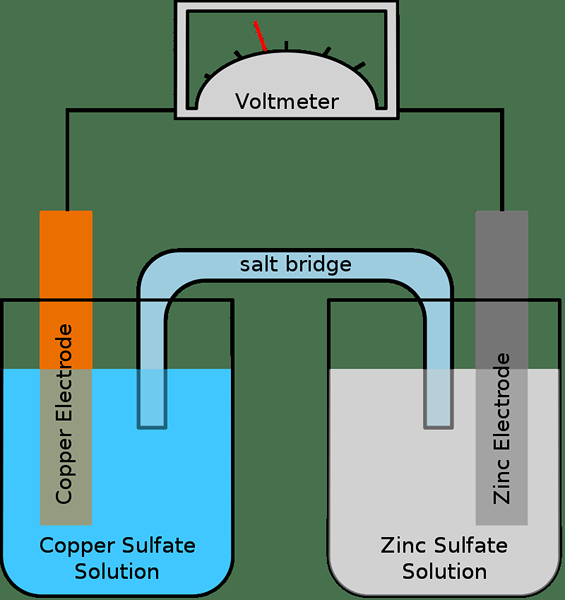
Abbildung 01: Eine einfache galvanische Zelle
Eine halbe Zelle besteht im Allgemeinen aus einer Elektrode und einem Elektrolyten. Daher hat eine vollständige elektrochemische Zelle zwei Elektroden und zwei Elektrolyte; Die beiden Halbzellen können manchmal denselben Elektrolyten verwenden. Wenn es zwei verschiedene Elektrolyte gibt, wird eine Salzbrücke verwendet, um den Kontakt zwischen den Elektrolyten aufrechtzuerhalten. Und dies geschieht, indem ein Durchgang durchgeführt wird, um Ionen durch die Salzbrücke zu übertragen. Die Elektronen fließen durch eine externe Schaltung von einer halben Zelle zur anderen. Wir nennen diese beiden Elektroden Anode und Kathode.
Darüber hinaus treten Oxidations- und Reduktionsreaktionen in zwei Elektroden getrennt auf. Während die Oxidationsreaktion in der Anode auftritt, tritt die Reduktionsreaktion in der Kathode auf. Daher werden Elektronen in der Anode erzeugt und bewegen sich von der Anode zur Kathode durch den externen Stromkreis. Die Salzbrücke hilft dabei, das System (elektrisch) neutral zu halten, indem Ionen durch sie übertragen werden, um die elektrischen Ladungen auszugleichen.
Was ist der Unterschied zwischen Konzentrationszellen und chemischer Zelle?
Konzentrationszelle ist eine Art elektrochemischer Zelle. Es gibt zwei Arten von chemischen Zellen; Sie sind die galvanischen und elektrolytischen Zellen. Die Konzentrationszelle ist eine Art galvanische Zelle. Der Schlüsselunterschied zwischen Konzentrationszellen und chemischer Zelle besteht darin, dass in Konzentrationszellen die Zusammensetzung von zwei Halbzellen ähnlich ist, während in chemischen Zellen die Zusammensetzungen ähnlich sind oder nicht.
Im Folgenden finden Sie eine Zusammenfassung des Unterschieds zwischen Konzentrationszellen und chemischer Zelle.
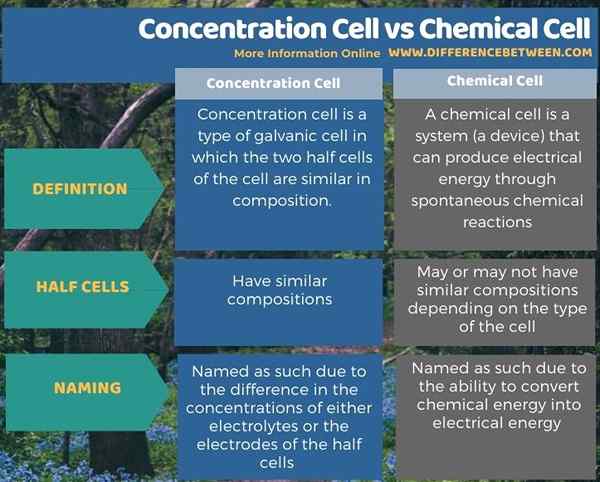
Zusammenfassung -Konzentrationszelle gegen chemische Zelle
Konzentrationszelle ist eine Art elektrochemischer Zelle. Es gibt zwei Arten von chemischen (elektrochemischen) Zellen können als galvanische Zellen und elektrolytische Zellen. Um genau zu sein, ist eine Konzentrationszelle eine Art galvanische Zelle. Der Schlüsselunterschied zwischen Konzentrationszellen und chemischer Zelle besteht darin.
Referenz:
1. Narendra Sriramula. „Chemische Zelle.Slideshare.Netz. Hier verfügbar.
Bild mit freundlicher Genehmigung:
1. "Cell 3" von 473Shhruthi V - eigene Arbeit (CC BY -SA 4.0) über Commons Wikimedia
2. "Galvanische Zelle" von Gringer - Datei: Galvanische Zelle.PNG nach Tinux (CC BY-SA 3.0) über Commons Wikimedia


