Unterschied zwischen Konjugation und Resonanz

Konjugation gegen Resonanz
Konjugation und Resonanz sind zwei wichtige Phänomene zum Verständnis des Verhaltens von Molekülen.
Was ist Konjugation?
In einem Molekül, wenn es wechselnde Einzel- und mehrere Bindungen vorhanden ist, sagen wir, dass das System konjugiert ist. Zum Beispiel ist Benzolmolekül ein konjugiertes System. In einer Mehrfachbindung gibt es eine Sigma -Bindung und ein oder zwei PI -Teiche. PI -Anleihen werden durch überlappende P -Orbitale erfunden. Die Elektronen in den P -Orbitalen befinden sich senkrecht zur Ebene des Moleküls. Wenn es also PI -Bindungen in abwechselnden Bindungen gibt, werden alle Elektronen im gesamten konjugierten System delokalisiert. Mit anderen Worten, wir nennen es eine Elektronenwolke. Da die Elektronen delokalisiert sind, gehören sie zu allen Atomen im konjugierten System, jedoch nicht nur für ein Atom. Dies senkt die Gesamtenergie des Systems und erhöht die Stabilität. Nicht nur die PI -Bindungen, sondern auch einsame Elektronenpaare, Radikale oder Carbeniumionen können an der Erstellung eines konjugierten Systems teilnehmen. In diesen Fällen gibt es entweder nicht gebundene P -Orbitale mit zwei Elektronen, einem Elektron oder keinen Elektronen vorhanden. Es gibt lineare und zyklische konjugierte Systeme. Einige sind nur auf ein Molekül beschränkt. Wenn es größere Polymerstrukturen gibt, kann es sehr große konjugierte Systeme geben. Das Vorhandensein von Konjugation ermöglicht es den Molekülen, als Chromophore zu wirken. Chromophoren können Licht aufnehmen; Daher wird die Verbindung gefärbt.
Was ist Resonanz?
Beim Schreiben von Lewis -Strukturen zeigen wir nur Valenzelektronen. Durch die Teilen oder Übertragung von Elektronen versuchen wir, jedem Atom die edle gas elektronische Konfiguration zu geben. Bei diesem Versuch können wir den Elektronen jedoch einen künstlichen Ort auferlegen. Infolgedessen können mehr als ein äquivalente Lewis -Strukturen für viele Moleküle und Ionen geschrieben werden. Die Strukturen, die durch Ändern der Position der Elektronen geschrieben wurden, werden als Resonanzstrukturen bezeichnet. Dies sind Strukturen, die nur theoretisch existieren. Die Resonanzstrukturen geben zwei Tatsachen über die Struktur an.
• Keine der Resonanzstrukturen ist die richtige Darstellung des tatsächlichen Moleküls. Und keiner wird den chemischen und physikalischen Eigenschaften des tatsächlichen Moleküls völlig ähneln.
• Das tatsächliche Molekül oder das Ion wird am besten durch eine Mischung aller Resonanzstrukturen dargestellt.
Die Resonanzstrukturen werden mit dem Pfeil ↔ angezeigt. Im Folgenden finden Sie die Resonanzstrukturen von Carbonation (CO)32-).
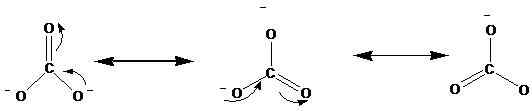
Röntgenstudien haben gezeigt, dass sich das tatsächliche Molekül zwischen diesen Resonanzen befindet. Nach den Studien sind alle Kohlenstoffoxygenbindungen im Carbonation in gleicher Länge liegen. Nach den oben genannten Strukturen können wir jedoch eine Doppelbindung und zwei einzelne Bindungen sehen. Wenn diese Resonanzstrukturen getrennt auftreten, sollte es im Idealfall unterschiedliche Bindungslängen im Ion geben. Die gleichen Bindungslängen zeigen, dass keine dieser Strukturen tatsächlich in der Natur vorhanden ist, sondern ein Hybrid davon existiert.
| Was ist der Unterschied zwischen Konjugation und Resonanz? • Resonanz und Konjugation sind miteinander verbunden. Wenn in einem Molekül Konjugation vorliegt, können wir Resonanzstrukturen darauf ziehen, indem wir die PI -Bindungen abwechseln. Da die PI -Elektronen im gesamten konjugierten System delokalisiert werden, sind alle Resonanzstrukturen für ein solches Molekül gültig. • Resonanz ermöglicht es einem konjugierten System, Elektronen zu delokalisieren. |


