Unterschied zwischen Dipol-Dipol und Londoner Dispersionskräften
Schlüsselunterschied - Dipol-Dipole gegen Londoner Dispersionskräfte
Dipol-Dipol- und Londoner Dispersionskräfte sind zwei Anziehungskräfte zwischen Molekülen oder Atomen; Sie beeinflussen direkt den Siedepunkt des Atom /Moleküls. Der Schlüsselunterschied Zwischen Dipol-Dipole und Londoner Dispersionskräfte ist ihre Stärke und wo sie gefunden werden können. Der Die Stärke der Londoner Dispersionskräfte sind relativ schwächer als Dipol-Dipol-Wechselwirkungen; Diese beiden Attraktionen sind jedoch schwächer als ionische oder kovalente Bindungen. Londoner Dispersionskräfte finden sich in jedem Molekül oder manchmal in Atomen, aber Dipol-Dipol-Wechselwirkungen sind nur in polaren Molekülen zu finden.
Was ist Dipol-Dipolkraft?
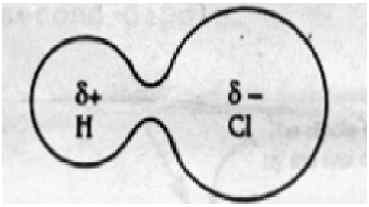
Dipol-Dipol-Wechselwirkungen treten auf, wenn zwei entgegengesetzt polarisierte Moleküle durch den Raum interagieren. Diese Kräfte existieren in allen Molekülen, die polar sind. Polare Moleküle werden gebildet, wenn zwei Atome einen Elektronegativitätsunterschied aufweisen, wenn sie eine kovalente Bindung bilden. In diesem Fall können Atome aufgrund des Elektronegativitätsunterschieds keine Elektronen gleichmäßig zwischen zwei Atomen teilen. Das elektronegativere Atom zieht die Elektronenwolke mehr an als das weniger elektronegative Atom. so dass das resultierende Molekül ein leicht positives Ende und ein leicht negatives Ende besitzt. Die positiven und negativen Dipole in anderen Molekülen können sich anziehen, und diese Anziehung wird als Dipol-Dipolkräfte bezeichnet.

Was ist London Dispersionskraft?
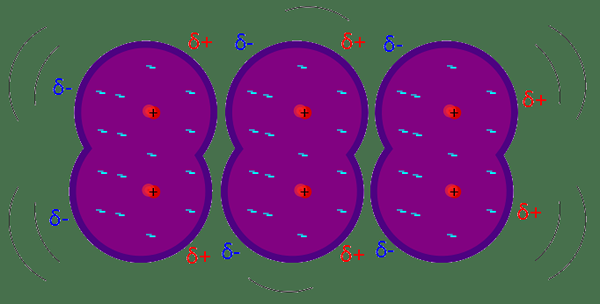
Londoner Dispersionskräfte werden als die schwächste intermolekulare Kraft zwischen benachbarten Molekülen oder Atomen angesehen. Londoner Dispersionskräfte führen zu Schwankungen der Elektronenverteilung im Molekül oder Atom. Zum Beispiel; Diese Arten von Anziehungskräften entstehen in benachbarten Atomen aufgrund eines augenblicklichen Dipols auf jedem Atom. Es induziert Dipol an benachbarten Atomen und zieht sich dann durch schwache Anziehungskräfte an. Die Größe der Londoner Dispersionskraft hängt davon ab, wie leicht die Elektronen am Atom oder im Molekül als Reaktion auf eine sofortige Kraft polarisiert werden können. Sie sind vorübergehende Kräfte, die in jedem Molekül verfügbar sein können, da sie Elektronen haben.

Was ist der Unterschied zwischen Dipol-Dipol und Londoner Dispersionskräften?
Definition:
Dipol-Dipol-Kraft: Dipol-Dipol-Kraft ist die Anziehungskraft zwischen dem positiven Dipol eines polaren Moleküls und dem negativen Dipol eines anderen entgegengesetzt polarisierten Moleküls.
Londoner Dispersionskraft: Die Londoner Dispersionskraft ist die vorübergehende attraktive Kraft zwischen benachbarten Molekülen oder Atomen, wenn die Elektronenverteilung schwankt.
Natur:
Dipol-Dipol-Kraft: Dipol-Dipol-Wechselwirkungen werden in polaren Molekülen wie HCl, BRCL und HBR gefunden. Dies ergibt. Die Elektronendichte verschiebt sich in Richtung des elektronegativeren Atom.
Londoner Dispersionskraft: Londoner Dispersionskräfte können in jedem Atom oder Molekül gefunden werden. Die Anforderung ist eine Elektronenwolke. Londoner Dispersionskräfte sind auch in nicht Pololaren Molekülen und Atomen vorhanden.
Stärke:
Dipol-Dipol-Kraft: Dipol-Dipolkräfte sind stärker als die Dispersionskräfte, aber schwächer als ionische und kovalente Bindungen. Die durchschnittliche Stärke der Dispersionskräfte variiert zwischen 1-10 kcal/mol.
Londoner Dispersionskraft: Sie sind schwach, weil Londoner Dispersionskräfte vorübergehende Kräfte sind (0-1 kcal/mol).
Faktoren beeinflussen:
Dipol-Dipol-Kraft: Die Affektfaktoren für die Stärke der Dipol-Dipolkräfte sind die Elektronegativitätsdifferenz zwischen Atomen im Molekül, der Molekülgröße und der Form des Moleküls. Mit anderen Worten, wenn die Bindungslänge zunimmt, nimmt die Dipol -Wechselwirkung ab.
Londoner Dispersionskraft: Die Größe der Londoner Dispersionskräfte hängt von mehreren Faktoren ab. Es nimmt mit der Anzahl der Elektronen im Atom zu. Polarisierbarkeit ist einer der wichtigen Faktoren, die die Stärke der Londoner Dispersionskräfte beeinflussen. Es ist die Fähigkeit, die Elektronenwolke durch ein anderes Atom/Molekül zu verzerren. Moleküle mit geringerer Elektronegativität und größere Radien haben eine höhere Polarisierbarkeit. Im Gegensatz; Es ist schwierig, die Elektronenwolke in kleineren Atomen zu verzerren, da die Elektronen sehr nahe am Kern liegen.
Beispiel:
| Atom | Siedepunkt / ÖC | |
| Helium | (Er) | -269 |
| Neon | (Ne) | -246 |
| Argon | (Ar) | -186 |
| Krypton | (KR) | -152 |
| Xenon | (Xe) | -107 |
| Redon | (RN) | -62 |
RN- Je größer das Atom, leicht zu polarisieren (höhere Polarisierbarkeit) und die stärksten attraktiven Kräfte besitzt. Helium ist sehr klein und schwer zu verzerren und führt zu schwächeren Londoner Dispersionskräften.
Bild mit freundlicher Genehmigung:
1. Dipole-Dipol-Interaktion-in-HCl-2D von Benjah-BMM27 (eigene Arbeit) [Public Domain] über Wikimedia Commons
2. Dezieren Sie di London von Riccardo Rovinetti (Eigene Arbeit) [CC BY-SA 3.0] über Wikimedia Commons


