Unterschied zwischen Elektrolyten und Nichtelektrolyten
Der Schlüsselunterschied zwischen Elektrolyten und Nichtelektrolyten ist das Elektrolyte können Ionen produzieren, wenn sie in Wasser gelöst werden, während Nichtelektrolyte keine Ionen produzieren können.
Wir können alle Verbindungen in zwei Gruppen als Elektrolyte und Nichtelektrolyte in Abhängigkeit von ihrer Fähigkeit, Ionen zu produzieren und Elektrizität zu leiten, kategorisieren. Der Prozess, einen Strom durch eine elektrolytische Lösung zu übertragen und positive und negative Ionen zu zwingen, sich in Richtung ihrer jeweiligen Elektroden zu bewegen, wird als „Elektrolyse“ bezeichnet.Nichtelektrolyten können jedoch nicht an Elektrolyseprozessen teilnehmen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind Elektrolyte
3. Was sind Nichtelektrolyten
4. Seite für Seitenvergleich - Elektrolyte gegenüber Nichtelektrolyten in tabellarischer Form
5. Zusammenfassung
Was sind Elektrolyte?
Elektrolyte sind Substanzen, die Ionen produzieren. Diese Verbindungen können Ionen produzieren, wenn sie sich im geschmolzenen Stadium befinden oder wenn sie in einem Lösungsmittel (Wasser) gelöst werden. Aufgrund von Ionen können Elektrolyte Elektrizität leiten. Es gibt auch Festkörperelektrolyte. Darüber hinaus produzieren einige Gase wie Kohlendioxid Ionen (Wasserstoff- und Bicarbonationen), wenn sie sich in Wasser auflösen.
Es gibt zwei Arten von Elektrolyten: starke Elektrolyte und schwache Elektrolyte. Starke Elektrolyte produzieren leicht Ionen, wenn sie löslich sind. Zum Beispiel sind ionische Verbindungen starke Elektrolyte. Geschmolzenes Natriumchlorid oder wässrige NaCl-Lösungen unterliegen vollständiger Dissoziation (in Na+und Klassen); So sind sie gute Stromleiter. Starke Säuren und Basen sind auch gute Elektrolyte. Schwache Elektrolyte produzieren nur wenige Ionen, wenn sie in Wasser löslich sind. Darüber hinaus sind schwache Säuren wie Essigsäure und schwache Basen schwache Elektrolyte.

Abbildung 01: Einige Elektrolyte im Vergleich
Elektrolyte im Körper
Elektrolyte sind auch in unserem Körper vorhanden. Wir brauchen sie, um das Gleichgewicht in Zellen und Blutflüssigkeiten in einem gesunden Körper aufrechtzuerhalten. Elektrolytbilanz ist entscheidend, um das osmotische Gleichgewicht und den Blutdruck im Körper aufrechtzuerhalten. N / A+, K+, und ca2+ sind wichtig für die Übertragung von Nervenimpulsen und Muskelkontraktionen.
Verschiedene Hormone in der Homöostase der Körpersteuerelektrolyt. Zum Beispiel kontrolliert Aldosteron die Na+-Begtheit. Calcitonin und Parathormonhormone spielen eine Rolle, um die CA aufrechtzuerhalten2+ und po43- Gleichgewicht. Wir können die Elektrolytspiegel des Blutes messen, um bestimmte Elektrolyt -Ungleichgewichte zu identifizieren. Meistens na+ und k+ Spiegel bei Blut- und Urinmessungen sind wichtig, um die Fehlfunktion des Nierens zu überprüfen. Die normale na+ Der Blutniveau beträgt 135 - 145 mmol/l, während der normale k+ Level ist 3.5 - 5.0 mmol/l. Extreme Niveaus von Elektrolyten im Körper können tödlich sein. Elektrolyte sind auch in Pflanzenkörpern wichtig. Zum Beispiel Elektrolyte (k)+) steuern Sie die Stomata -Öffnungs- und Schließmechanismen durch Wachzellen.
Was sind Nichtelektrolyten?
Die Verbindungen, die nicht in positive und negative Ionen aufgeteilt werden, wenn wir sie in Lösungsmitteln auflösen. Das geschmolzene Stadium dieser Verbindungen erzeugt auch keine Ionen. Das Fehlen von Ionen im Medium macht sie nicht leitend. Meistens gehören Verbindungen mit nichtpolaren kovalenten Bindungen/ organischen Verbindungen zu dieser Gruppe. Zum Beispiel Saccharose, Glukose, Ethan usw.
Was ist der Unterschied zwischen Elektrolyten und Nichtelektrolyten?
Der Schlüsselunterschied zwischen Elektrolyten und Nichtelektrolyten besteht darin, dass Elektrolyte Ionen produzieren können, wenn sie in Wasser gelöst werden, während Nichtelektrolyten keine Ionen produzieren können. Ionische Verbindungen und einige Verbindungen mit polaren Bindungen können Elektrolyte sein. Verbindungen mit nichtpolaren Bindungen sind meistens Nichtelektrolyte. Darüber hinaus können Elektrolyte in Lösungen Elektrizität im Widerspruch zu Nichtelektrolyten leiten.
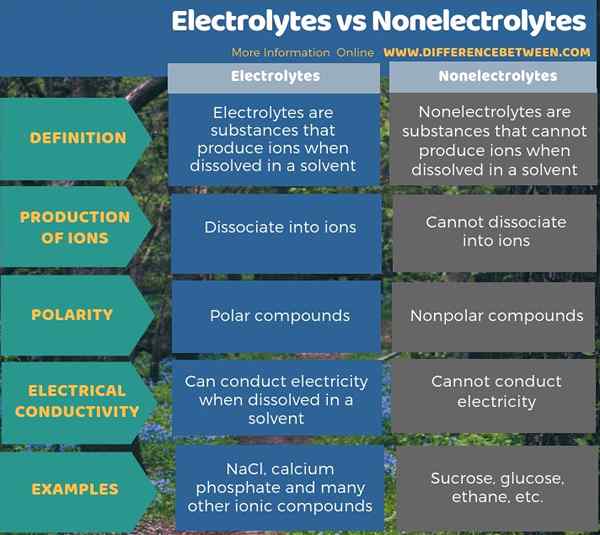
Zusammenfassung -Elektrolyte gegenüber Nichtelektrolyten
Alle Verbindungen, die wir kennen, sind entweder Elektrolyte oder Nichtelektrolyte. Der Schlüsselunterschied zwischen Elektrolyten und Nichtelektrolyten besteht darin, dass Elektrolyte Ionen produzieren können, wenn sie in Wasser gelöst werden, aber Nichtelektrolyte können keine Ionen produzieren.
Referenz:
1. Helmenstine, Anne Marie. „Starke Elektrolytdefinition und Beispiele.”Thoughtco, Jul. 3, 2019, hier erhältlich.
2. Helmenstine, Anne Marie. „Beispiele für Chemie: Starke und schwache Elektrolyte.”Thoughtco, August. 6, 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
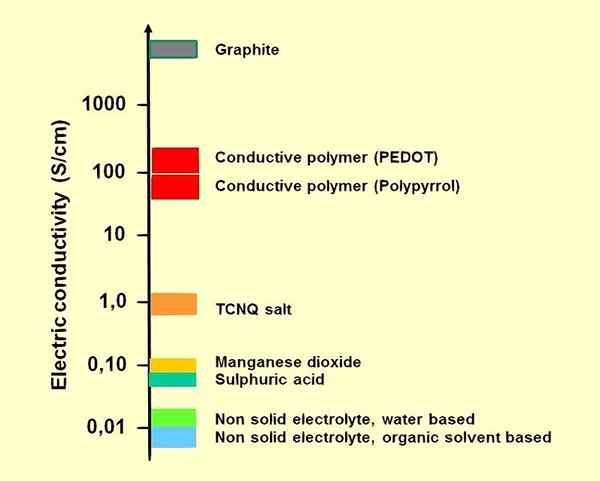
1. "Elektrolyteselektrische Leitfähigkeit" durch ELCAP - eigene Arbeit (CC0) über Commons Wikimedia


