Unterschied zwischen Elektronegativität und Ionisationsenergie
Der Schlüsselunterschied Zwischen Elektronegativität und Ionisationsenergie ist das Elektronegativität erklärt die Anziehungskraft von Elektronen, während sich Ionisationsenergie auf die Entfernung von Elektronen aus einem Atom bezieht.
Atome sind die Bausteine aller vorhandenen Substanzen. Sie sind so winzig, dass wir sie nicht einmal mit unserem bloßen Auge beobachten können. Ein Atom besteht aus einem Kern, der Protonen und Neutronen hat. Zusätzlich zu Neutronen und Positronen gibt es andere kleine subatomare Partikel im Kern, und in Orbitalen kreisen Elektronen um den Kern um. Aufgrund des Vorhandenseins von Protonen haben Atomkerne eine positive Ladung. Die Elektronen im äußeren Bereich haben eine negative Ladung. Daher bewahren die attraktiven Kräfte zwischen den positiven und negativen Ladungen des Atoms seine Struktur auf.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Elektronegativität
3. Was ist Ionisierungsenergie
4. Seite an Seite Vergleich -Elektronegativität gegenüber Ionisationsenergie in tabellarischer Form
5. Zusammenfassung
Was ist Elektronegativität?
Elektronegativität ist die Tendenz eines Atoms, die Elektronen in einer Bindung dazu anzulocken. Mit anderen Worten, dies zeigt die Anziehungskraft eines Atoms auf die Elektronen. Wir verwenden üblicherweise die Paulingskala, um die Elektronegativität von Elementen anzuzeigen.
In der Periodenzüchter ändert sich die Elektronegativität entsprechend einem Muster. In einem Zeitraum von links nach rechts steigt die Elektronegativität und von oben nach unten in einer Gruppe nimmt die Elektronegativität ab. Daher ist Fluor das elektronegativste Element mit einem Wert von 4.0 auf der Paulingskala. Gruppe eins und zwei Elemente haben weniger Elektronegativität; Daher neigen sie dazu, positive Ionen zu bilden, indem sie Elektronen geben. Da Gruppe 5, 6, 7 Elemente einen höheren Elektronegativitätswert haben, nehmen sie gerne Elektronen in und von negativen Ionen ein.
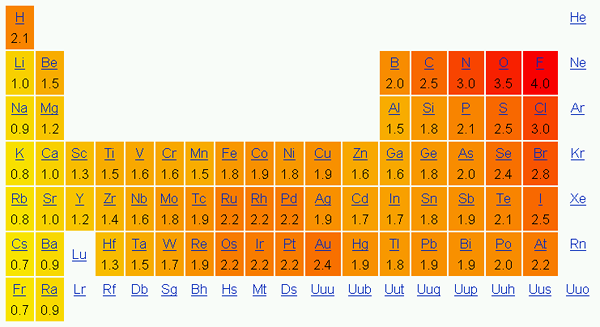
Abbildung 01: Elektronegativität gemäß der Paulingskala
Elektronegativität ist auch wichtig für die Bestimmung der Art von Bindungen. Wenn die beiden Atome in der Bindung keinen Elektronegativitätsunterschied aufweisen, bildet sich eine reine kovalente Bindung. Wenn der Elektronegativitätsunterschied zwischen beiden hoch ist, ist eine ionische Bindung das Ergebnis. Wenn es einen kleinen Unterschied gibt, bildet sich eine polare kovalente Bindung.
Was ist Ionisierungsenergie?
Ionisierungsenergie ist die Energie, die einem neutralen Atom gegeben werden sollte, um ein Elektron daraus zu entfernen. Die Entfernung eines Elektrons bedeutet, es einen unendlichen Abstand von den Spezies zu entfernen, so dass keine Anziehungskräfte zwischen dem Elektron und dem Kern vorhanden sind (vollständige Entfernung).
Wir können Ionisationsenergien als erste Ionisationsenergie, zweite Ionisationsenergie usw. nennen, abhängig von der Anzahl der aus dem Atom entfernten Elektronen. Gleichzeitig führt dies zu Kationen mit +1, +2, +3 Gebühren usw.

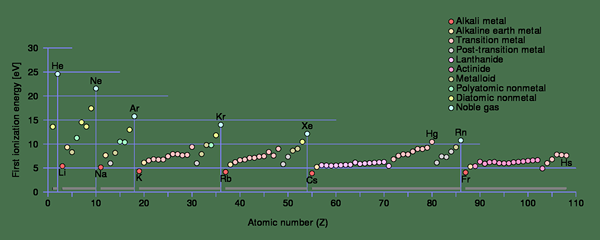
Abbildung 1: Ionisationsenergietrends für die erste Ionisation in jeder Periode der Periodenzüchter
In kleinen Atomen ist der Atomradius klein. Daher sind die elektrostatischen Anziehungskräfte zwischen dem Elektron und dem Neutron viel höher als mit einem Atom mit einem größeren Atomradius. Es erhöht die Ionisationsenergie eines kleinen Atoms. Wenn das Elektron näher am Kern liegt, ist die Ionisationsenergie höher.
Darüber hinaus variieren die ersten Ionisationsenergien unterschiedlicher Atome ebenfalls. Beispielsweise ist die erste Ionisationsenergie von Natrium (496 kJ/mol) viel niedriger als die erste Ionisationsenergie von Chlor (1256 kJ/mol). Es liegt daran, dass Natrium durch das Entfernen eines Elektrons die Edelgaskonfiguration gewinnen kann. Daher entfernt es leicht das Elektron. Darüber hinaus ist der Atomabstand bei Natrium geringer als in Chlor, was die Ionisationsenergie senkt. Daher steigt die Ionisationsenergie in einer Spalte der Periodenzüchter von links nach rechts und unten nach oben (dies ist die Umkehrung der Atomgrößenerhöhung in der Periodenzüchttabelle). Bei der Entfernung von Elektronen gibt es einige Fälle, in denen die Atome stabile Elektronenkonfigurationen erhalten. Zu diesem Zeitpunkt neigen Ionisierungsenergien dazu, in einen höheren Wert zu springen.
Unterschied zwischen Elektronegativität und Ionisationsenergie?
Elektronegativität ist die Tendenz eines Atom. Daher besteht der Hauptunterschied zwischen Elektronegativität und Ionisationsenergie darin, dass die Elektronegativität die Anziehungskraft von Elektronen erklärt, während Ionisationsenergie auf die Entfernung von Elektronen aus einem Atom bezieht.
Darüber hinaus gibt es einen weiteren signifikanten Unterschied zwischen Elektronegativität und Ionisationsenergie, basierend auf ihren Trends in der Periodenschaftstabelle von Elementen. Die Elektronegativität nimmt in einem Zeitraum von links nach rechts zu und nimmt von oben nach unten auf einer Gruppe ab. Während die Ionisationsenergie in einer Spalte der Periodenzüchter von links nach rechts und unten nach oben steigt. Manchmal gewinnen die Atome jedoch stabile Elektronenkonfigurationen und somit tendenziell Ionisierungsenergien in einen höheren Wert springen.
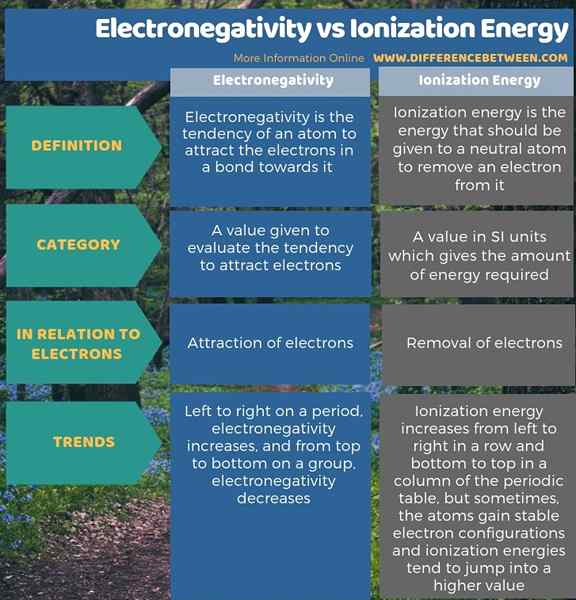
Zusammenfassung -Elektronegativität gegenüber Ionisierungsenergie
Die Begriffe Elektronegativität und Ionisationsenergie erklären die Wechselwirkungen zwischen Atomkern und Elektronen. Der Hauptunterschied zwischen Elektronegativität und Ionisationsenergie besteht darin, dass die Elektronegativität die Anziehungskraft von Elektronen erklärt, während Ionisationsenergie die Entfernung von Elektronen aus einem Atom bezieht.
Referenz:
1. Helmenstine, Anne Marie. „Elektronegativitätsdefinition und Beispiele.”Thoughtco, Oktober. 17, 2018, hier erhältlich.
2. Helmenstine, Anne Marie. „Ionisation Energy Definition und Trend.”Thoughtco, Jan. 24, 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Taula Periòdica Electronegativitat" von Joanjoc im katalanischen Wikipedia - übertragen von CA.Wikipedia to Commons (Public Domain) über Commons Wikimedia
2. "Erste Ionisationsenergie" von Sponk (PNG-Datei) GLRX (SVG-Datei) Wylve (Zh-Hans, ZH-Hant) Paloinns , BS, SH) Depiep (Element.png von sponk (cc von 3.0) über Commons Wikimedia


