Unterschied zwischen Elektronegativität und Polarität
Der Schlüsselunterschied Zwischen Elektronegativität und Polarität ist das Elektronegativität ist die Tendenz eines Atoms, die Elektronen in eine Bindung dazu zu gewinnen.
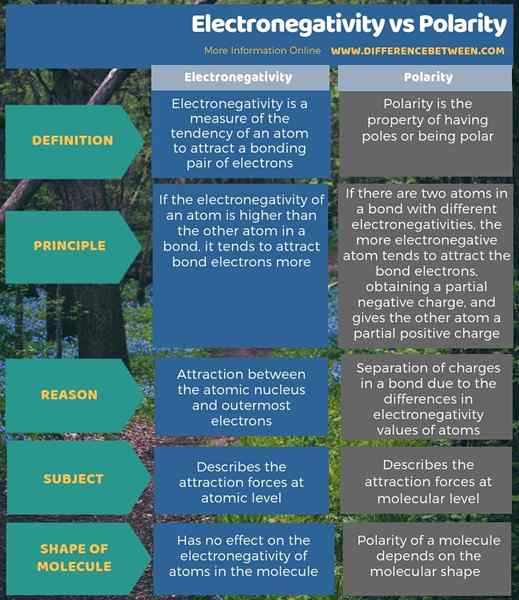
Polarität entsteht aufgrund der Unterschiede in der Elektronegativität. Daher sind diese beiden Begriffe eng verwandte Begriffe. Es gibt jedoch einen deutlichen Unterschied zwischen Elektronegativität und Polarität. Ein solcher Unterschied zwischen Elektronegativität und Polarität besteht darin, dass die Elektronegativität die Anziehungskräfte auf atomarer Ebene beschreibt, während die Polarität die Anziehungskräfte auf molekularer Ebene beschreibt.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Elektronegativität
3. Was ist Polarität
4. Seite an Seite Vergleich - Elektronegativität gegenüber Polarität in tabellarischer Form
5. Zusammenfassung
Was ist Elektronegativität?
Elektronegativität ist die Tendenz eines Atoms, die Elektronen in einer Bindung dazu anzulocken. Grundsätzlich zeigt dies die „Ähnlichkeit“ eines Atoms gegenüber den Elektronen. Wir können die Paulingskala verwenden, um die Elektronegativität von Elementen anzuzeigen.
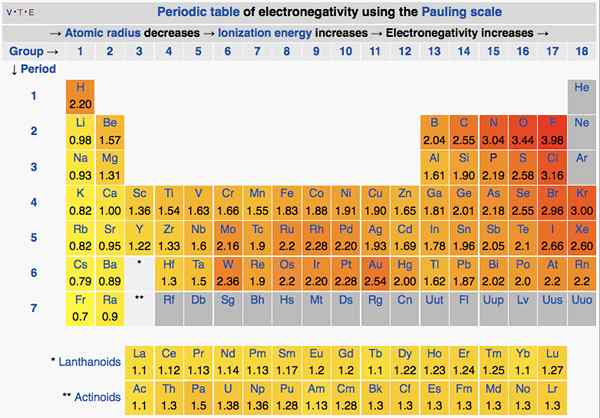
In der Periodenzüchter ändert sich die Elektronegativität entsprechend einem Muster. Von links nach rechts steigt die Elektronegativität in einem Zeitraum. Von oben nach unten nimmt die Elektronegativität auf einer Gruppe ab. Daher ist Fluor das elektronegativste Element mit einem Wert von 4.0 auf der Paulingskala. Gruppe eins und zwei Elemente haben weniger Elektronegativität; Daher neigen sie dazu, positive Ionen zu bilden, indem sie Elektronen geben. Da Gruppe 5, 6, 7 Elemente einen höheren Elektronegativitätswert haben, nehmen sie gerne Elektronen in und von negativen Ionen ein.

Abbildung 01: Elektronegativität von Elementen in der Periodenzüchtertabelle
Elektronegativität ist auch wichtig für die Bestimmung der Art von Bindungen. Wenn die beiden Atome in der Bindung keinen Elektronegativitätsunterschied haben, bildet sich eine kovalente Bindung. Wenn der Unterschied der Elektronegativität zwischen den beiden hoch ist, bildet sich eine ionische Bindung.
Was ist Polarität?
Polarität entsteht aufgrund der Unterschiede in der Elektronegativität von Atomen. Wenn zwei derselben Atome oder Atome mit der gleichen Elektronegativität eine Bindung zwischen ihnen bilden, ziehen diese Atome das Elektronenpaar auf ähnliche Weise. Daher neigen sie dazu, die Elektronen zu teilen, und diese Art von unpolaren Bindungen ist als kovalente Bindungen bekannt. Wenn die beiden Atome jedoch unterschiedlich sind, sind ihre Elektronegativitäten oft unterschiedlich. Aber der Grad der Differenz kann höher oder niedriger sein. Daher wird das gebundene Elektronenpaar im Vergleich zu dem anderen Atom, der an der Herstellung der Bindung beteiligt ist. Somit führt es zu einer ungleichen Verteilung der Elektronen zwischen den beiden Atomen. Darüber hinaus werden diese Arten von kovalenten Bindungen als polare Bindungen bezeichnet.
Aufgrund der ungleichmäßigen Teile von Elektronen wird ein Atom eine etwas negative Ladung haben, während das andere Atom eine etwas positive Ladung hat. In diesem Fall sagen wir, dass die Atome eine teilweise negative oder teilweise positive Ladung erhalten haben. Das Atom mit einer höheren Elektronegativität erhält die teilweise negative Ladung, und das Atom mit der niedrigeren Elektronegativität erhält die teilweise positive Ladung. Polarität bezieht sich auf die Trennung der Anklage. Diese Moleküle haben einen Dipolmoment.
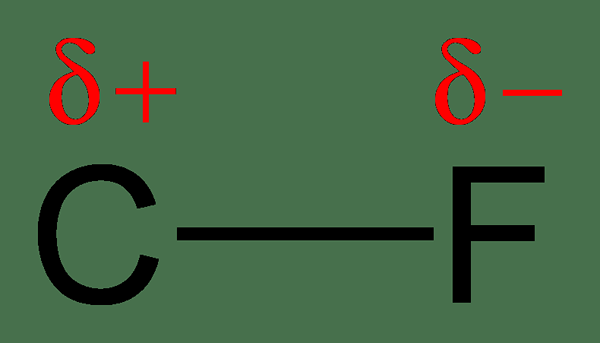
Abbildung 2: Ladungstrennung in der C-F-Bindung; Fluor ist elektronegativer als Kohlenstoff
In einem Molekül kann es mindestens eine Bindung oder mehr geben. Einige Bindungen sind polar, während andere nicht Polar sind. Damit ein Molekül polar ist, sollten alle Bindungen gemeinsam eine ungleiche Ladungsverteilung innerhalb des Moleküls erzeugen.
Polare Moleküle
Darüber hinaus haben Moleküle unterschiedliche Geometrien, sodass die Verteilung der Bindungen auch die Polarität des Moleküls bestimmt. Zum Beispiel ist Wasserstoffchlorid ein polares Molekül mit nur einer Bindung. Wassermolekül ist ein polares Molekül mit zwei Bindungen. Das Dipolmoment in diesen Molekülen ist dauerhaft, da sie aufgrund der Elektronegativitätsunterschiede entstanden sind. Es gibt jedoch andere Moleküle, die nur bei bestimmten Gelegenheiten polar sein können. Ein Molekül mit einem dauerhaften Dipol kann einen Dipol in einem anderen nicht-polaren Molekül induzieren, das dann auch zu temporären polaren Molekülen wird. Auch innerhalb eines Moleküls können bestimmte Veränderungen zu einem temporären Dipolmoment führen.
Was ist der Unterschied zwischen Elektronegativität und Polarität?
Die Elektronegativität ist ein Maß für die Tendenz eines Atom. Der Hauptunterschied zwischen Elektronegativität und Polarität besteht also darin, dass die Elektronegativität die Tendenz eines Atoms ist, die Elektronen in einer Bindung dazu anzulocken, während Polarität die Trennung der Ladungen ist.
Darüber hinaus besteht ein zusätzlicher Unterschied zwischen Elektronegativität und Polarität darin, dass die Elektronegativität die Anziehungskräfte auf atomarer Ebene beschreibt, während die Polarität die Anziehungskräfte auf molekularer Ebene beschreibt. Daher ist die Anziehungskraft zwischen dem Atomkern und den äußersten Elektronen der Grund, warum ein Atom einen Elektronegativitätswert hat. Somit bestimmt es den Wert der Elektronegativität. Polarität wird jedoch durch die Trennung von Ladungen in einer Bindung aufgrund der Unterschiede in den Elektronegativitätswerten von Atomen verursacht.
Die folgende Infografik zeigt weitere Details zum Unterschied zwischen Elektronegativität und Polarität.
Zusammenfassung -Elektronegativität gegenüber Polarität
Elektronegativität und Polarität sind verwandte Begriffe; Die Elektronegativität von Atomen in einem Molekül bestimmt die Polarität des Moleküls. Der Hauptunterschied zwischen Elektronegativität und Polarität besteht darin, dass die Elektronegativität die Tendenz eines Atoms ist, die Elektronen in einer Bindung dazu anzulocken, während Polarität die Trennung der Ladungen bedeutet.
Referenz:
1. Helmenstine, Anne Marie. „Elektronegativitätsdefinition und Beispiele.”Thoughtco, Oktober. 17, 2018, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Periodisch -Tabelle Pauling Electronegatvity" von DMACKS - (CC BY -SA 3.0) über Commons Wikimedia
2. "Carbon-Fluorin-Bond-Polarity-2D" von Ben Mills-eigene Arbeit (Public Domain) über Commons Wikimedia


