Unterschied zwischen Endpunkt und stöchiometrischem Punkt
Der Schlüsselunterschied Zwischen Endpunkt und stöchiometrischem Punkt ist das Der Endpunkt kommt kurz nach dem stöchiometrischen Punkt, während der stöchiometrische Punkt der genaueste Punkt ist, an dem die Neutralisation abgeschlossen ist.
Eine Säure-Base-Titration beinhaltet eine Neutralisationsreaktion, die an dem Punkt auftritt. Es gibt jedoch einen geringfügigen Unterschied zwischen dem theoretischen Punkt, an dem die Reaktion genau endet, und dem Punkt, an dem wir sie praktisch erkennen. Darüber hinaus sollten Sie auch beachten, dass der Begriff Äquivalenzpunkt ein häufig verwendeter Name für stöchiometrische Punkt ist.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Endpunkt
3. Was ist stöchiometrischer Punkt?
4. Seite an Seite Vergleich - Endpunkt gegen stöchiometrische Punkt in tabellarischer Form
5. Zusammenfassung
Was ist Endpunkt?
Der Punkt, an dem eine Reaktion abgeschlossen zu sein scheint, ist der Endpunkt der Titration. Wir können diesen Punkt experimentell bestimmen. Betrachten wir ein Beispiel, um dies praktisch zu verstehen. Angenommen, wir titrieren 100 ml von 0.1 M Salzsäure (HCl) mit 0.5 m Natriumhydroxid.
HCl(aq) + Naoh(aq) ⟶ h2O + NaCl(aq)
Wir behalten Säure im Titrationskolben und titrieren gegen NaOH in Gegenwart von Methylorange als Indikator. In saurem Medium ist der Indikator farblos und zeigt eine rosa Farbe im Basismedium. Anfangs gibt es nur Säure (HCl 0.1 m/100 ml) im Titrationsflasche; Der pH -Wert der Lösung ist gleich 2. Wenn wir NaOH hinzufügen, nimmt der pH -Wert der Lösung aufgrund der Neutralisation einer gewissen Säuremenge im Medium zu. Wir müssen die Basis kontinuierlich ab Drop hinzufügen, bis sie die Fertigstellung erreicht. Der pH -Wert der Reaktion wird gleich 7, wenn die Reaktion abgeschlossen ist. Auch an diesem Punkt zeigt der Indikator keine Farbe im Medium, da er die Farbe im Basismedium verändert.
Um die Farbänderung zu beobachten, müssen wir einen weiteren Tropfen NaOH hinzufügen, auch nach Abschluss der Neutralisation. Der pH -Wert der Lösung ändert sich an diesem Punkt drastisch. Dies ist der Punkt, an dem wir beobachten, wie die Reaktion abgeschlossen ist.
Was ist stöchiometrischer Punkt??
Der Äquivalenzpunkt ist der gebräuchliche Name für den stöchiometrischen Punkt. Es ist der Punkt, an dem Säure oder Base seine Neutralisationsreaktion vervollständigt. An diesem Punkt wird theoretisch eine Reaktion abgeschlossen, aber praktisch können wir den genauen Punkt nicht beobachten. Es ist besser, wenn wir bestimmen können, wann der äquivalente Punkt erreicht ist. Wir können jedoch die Reaktionsabschluss am Endpunkt beobachten.

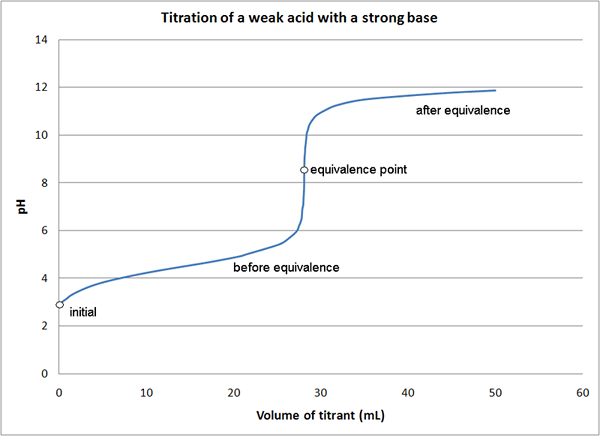
Abbildung 01: Diagramm für eine Titration, die den Äquivalenzpunkt zeigt
Wenn wir das gleiche Beispiel wie oben betrachten, haben wir zu Beginn der Reaktion nur die Säure im Medium (HCl). Bevor es den Äquivalenzpunkt erreicht, haben wir mit NaOH nicht umgesetzt und bildeten ein Salz (HCL und NaCl). Am Äquivalenzpunkt haben wir nur Salz im Medium. Am Endpunkt haben wir Salz und die Basis (NaCl und Naoh) im Medium.
Was ist der Unterschied zwischen Endpunkt und stöchiometrischem Punkt?
Endpunkt und stöchiometrischer Punkt (in gemeinsamen Äquivalenzpunkt) unterscheiden sich immer voneinander. Der Hauptunterschied zwischen Endpunkt und stöchiometrischer Punkt besteht darin. Darüber hinaus können wir den Endpunkt beobachten, können aber den stöchiometrischen Punkt praktisch nicht beobachten.

Zusammenfassung -Endpunkt gegen stöchiometrische Punkt
Endpunkt und stöchiometrischer Punkt (in gemeinsamen Äquivalenzpunkt) unterscheiden sich immer voneinander. Der Hauptunterschied zwischen Endpunkt und stöchiometrischer Punkt besteht darin.
Referenz:
1. Helmenstine, Anne Marie. „Äquivalenzpunktdefinition.Denkweise Mai. 7, 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1.”Titration von schwacher Säure mit starker Base” von Quantumkinetics - eigene Arbeit (CC von 3.0) über Commons Wikimedia


