Unterschied zwischen freier Energie und Aktivierungsenergie
Der Schlüsselunterschied Zwischen freier Energie und Aktivierungsenergie ist das freie Energie ist die Menge an Energie für ein thermodynamisches System zur Durchführung thermodynamischer Arbeit zur Verfügung, während die Aktivierungsenergie einer chemischen Reaktion die Energiebarriere ist, die überwunden werden muss, um Produkte aus der Reaktion zu erhalten.
Freie Energie und Aktivierungsenergie sind zwei verschiedene Begriffe, die auch unterschiedliche Anwendungen haben. Der Begriff freie Energie wird in Bezug auf thermodynamische Systeme in der physikalischen Chemie verwendet, während der Begriff Aktivierungsenergie hauptsächlich in Bezug auf chemische Reaktionen in der Biochemie verwendet wird.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist freie Energie
3. Was ist Aktivierungsenergie
4. Seite für Seitenvergleich - freie Energie gegen Aktivierungsenergie in tabellarischer Form
5. Zusammenfassung
Was ist freie Energie?
Freie Energie ist die Menge an Energie, die für ein thermodynamisches System zur Durchführung thermodynamischer Arbeit verfügbar ist. Freie Energie hat die Abmessungen der Energie. Der Wert der freien Energie eines thermodynamischen Systems wird durch den gegenwärtigen Zustand des Systems bestimmt, nicht durch seine Geschichte. Es gibt zwei Haupttypen freier Energie, die häufig in der Thermodynamik diskutiert werden: Helmholtz -freie Energie und Gibbs freie Energie.
Helmholtz -freie Energie ist die Energie, die in einem geschlossenen thermodynamischen System erhältlich ist, um die thermodynamische Arbeit bei konstanter Temperatur und Volumen auszuführen. Daher zeigt der negative Wert der Helmholtz -Energie die maximale Arbeit an, die ein thermodynamisches System durch Halten seiner Volumenkonstante durchführen kann. Um das Volumen konstant zu halten, wird ein Teil der gesamten thermodynamischen Arbeit als Grenzarbeit durchgeführt (um die Grenze des Systems so zu halten, wie es ist).
Gibbs freie Energie ist die Energie, die in einem geschlossenen, thermodynamischen System verfügbar ist, um die thermodynamische Arbeit bei konstanter Temperatur und Druck auszuführen. Das Volumen des Systems kann variieren. Freie Energie wird mit G bezeichnet.
Was ist Aktivierungsenergie?
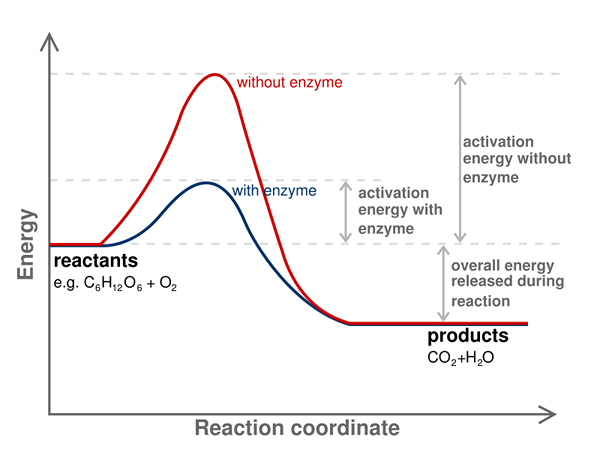
Aktivierungsenergie einer chemischen Reaktion ist die Energiebarriere, die überwunden werden muss, um Produkte aus der Reaktion zu erhalten. Mit anderen Worten, es ist die minimale Energie, die für einen Reaktanten erforderlich ist, um in ein Produkt umzuwandeln. Es ist immer notwendig, Aktivierungsenergie bereitzustellen, um eine chemische Reaktion zu starten.
Wir bezeichnen Aktivierungsenergie als eA oder ae; Wir messen es an der Einheit kJ/mol. Darüber hinaus wird Aktivierungsenergie als die minimale Energie angesehen. Einige chemische Reaktionen haben einen langsamen Fortschreiten und erfolgen über zwei oder mehr Schritte. Hier werden Zwischenprodukte gebildet und dann neu angeordnet, um das Endprodukt zu bilden. Daher ist die Energie, die für die Start dieser Reaktion erforderlich ist.

Darüber hinaus können Katalysatoren die Aktivierungsenergie reduzieren. Daher werden häufig Katalysatoren verwendet, um die Energiebarriere zu überwinden und die chemische Reaktion voranzubringen. Enzyme sind biologische Katalysatoren, die die Aktivierungsenergie der Reaktion in Geweben verringern können.
Was ist der Unterschied zwischen freier Energie und Aktivierungsenergie?
Freie Energie und Aktivierungsenergie sind zwei verschiedene Begriffe, die auch unterschiedliche Anwendungen haben. Der Hauptunterschied zwischen freier Energie und Aktivierungsenergie besteht darin, dass freie Energie die Menge an Energie ist, die einem thermodynamischen System zur Durchführung thermodynamischer Arbeit zur Verfügung steht die Reaktion.
Nachfolgend finden Sie die Zusammenfassung der Differenz zwischen freier Energie und Aktivierungsenergie in tabellarischer Form.
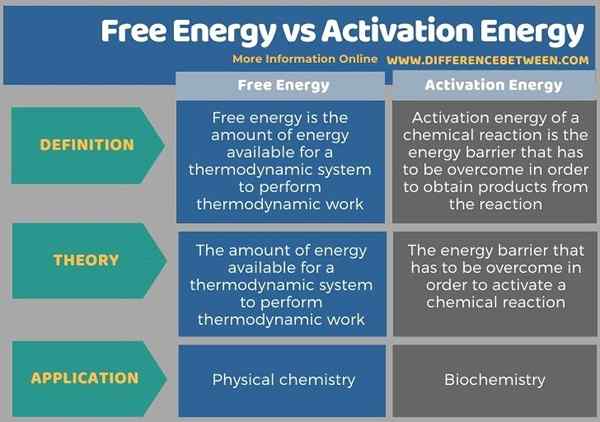
Zusammenfassung -freie Energie gegen Aktivierungsenergie
Freie Energie und Aktivierungsenergie sind zwei verschiedene Begriffe mit unterschiedlichen Anwendungen. Der Hauptunterschied zwischen freier Energie und Aktivierungsenergie besteht darin, dass freie Energie die Menge an Energie ist, die einem thermodynamischen System zur Durchführung thermodynamischer Arbeit zur Verfügung steht die Reaktion.
Referenz:
1. Helmenstine, Anne Marie. „Aktivierungsenergiedefinition in der Chemie.”Thoughtco, August. 27, 2020, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Activation2 Aktualisiert" ursprünglich von Jerry Crimson Mann hochgeladen, durch Tutmose vektorisiert, korrigiert von FVasconcellos - EN: Bild: Activation2.PNG (CC BY-SA 3.0) über Commons Wikimedia


