Unterschied zwischen den Elementen der Gruppe 1 und der Gruppe 2
Der Schlüsselunterschied Zwischen Gruppe 1 und Gruppe 2 ist das Alle Elemente der Gruppe 1 haben ungepaarte Elektronen in ihrem äußersten Orbital, während die Elemente der Gruppe 2 gepaarte Elektronen in ihrem äußersten Umlauf.
Die Gruppen 1 und 2 der Periodenzüchter enthalten S -Blockelemente. Das bedeutet; Diese Elemente haben ihre äußersten Elektronen im S -Orbital. Die Gruppe 1 und 2 unterscheidet sich je nach Anzahl der Elektronen in ihrem äußersten Orbital voneinander. Ein S -Orbital kann nur zwei Elektronen enthalten, da die magnetische Quantenzahl dieses Orbitals 0 beträgt.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind Elemente der Gruppe1
3. Was sind Elemente der Gruppe 2
4. Seite für Seitenvergleich - Gruppe 1 gegen Gruppe 2 Elemente in tabellarischer Form
5. Zusammenfassung
Was sind Elemente der Gruppe 1?
Elemente der Gruppe 1 sind chemische Elemente mit einem ungepaarten Elektron im äußersten S -Orbital mit. Es ist die erste Spalte des S -Blocks der Periodenzüchtertabelle. Es enthält Wasserstoff- und Alkali -Metalle. Die Mitglieder dieser Gruppe 1 sind wie folgt:
- Wasserstoff (H)
- Lithium (li)
- Natrium (Na)
- Kalium (k)
- Rhubidium (RH)
- Cäsium (CS)
- Francium (Fr)

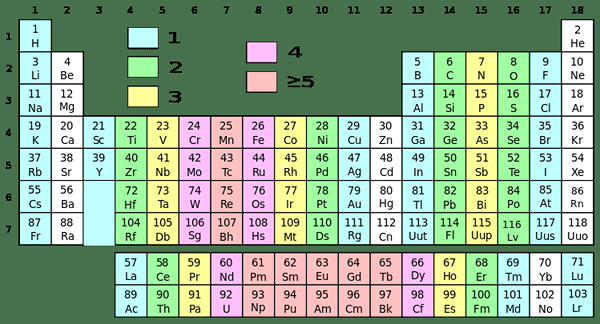
Abbildung 01: Periodenzüchter mit verschiedenen Gruppen in verschiedenen Farben
Obwohl Wasserstoff aufgrund ihrer Elektronenkonfiguration in dieser Gruppe ist, weist sie Eigenschaften von Alkali -Metallen auf. Zum Beispiel existiert Wasserstoff als Gas, während andere Elemente in dieser Gruppe Metalle sind. Diese Metalle sind alle glänzend, hochreaktiv und sehr weich (wir können sie leicht mit einem einfachen Messer schneiden).
Im Allgemeinen zeigen die Elemente der Gruppe 1 niedrige Dichten, niedrige Schmelzpunkte, niedrige Siedepunkte und weisen körperzentrierte kubische Kristallstrukturen auf. Darüber hinaus haben sie unterschiedliche Flammenfarben, sodass wir sie leicht unterscheiden können, indem wir eine Probe einem Bunsen -Brenner aussetzen. Wenn Sie die Gruppe der Alkali -Metalle hinuntergehen, gibt es einige regelmäßige Variationen, die unten aufgeführt sind.
- Die Atomgröße nimmt zu
- Der Schmelzpunkt und der Siedepunkt nehmen aufgrund der Fähigkeit, starke Bindungen zu bilden, die Gruppe ab (wenn das Atom groß wird, ist die gebildete Bindung schwach).
- Die Dichte nimmt zu.
- Die erste Ionisierungsenergie nimmt ab, da bei großen Atomen das äußerste Elektron lose gebunden ist und leicht entfernt werden kann.
- Elektronegativität
- Die Reaktivität nimmt ab.
- Alkali -Metalle haben niedrige Elektronenaffinitäten als andere Elemente.
Was sind Elemente der Gruppe 2?
Elemente der Gruppe 2 sind chemische Elemente mit ihrem äußersten Elektronenpaar in einem S -Orbital. Daher befinden sich ihre Valenzelektronen in Form von NS2. Ferner ist diese Gruppe die zweite Spalte des S -Blocks. Wir nennen sie als alkalische Erdmetalle. Die Mitglieder dieser Gruppe sind wie folgt:
- Beryllium (BE)
- Magnesium (mg)
- Kalzium (CA)
- Strontium (SR)
- Barium (BA)
- Radium (RA)
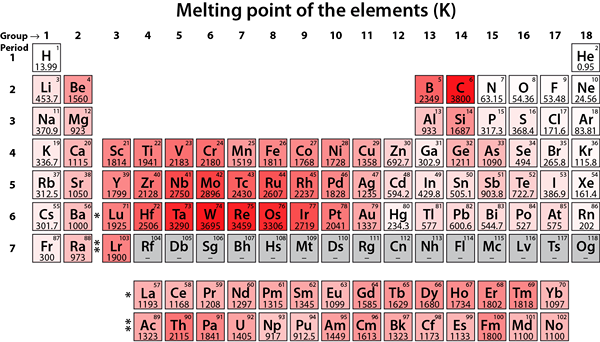
Abbildung 02: Schmelzpunkte von Elementen
Diese Metallelemente neigen dazu, ihre Elektronenkonfiguration zu stabilisieren, indem zwei äußerste Elektronen entfernt werden, um eine Edelgaselektronenkonfiguration zu erhalten. Daher bilden diese Elemente +2 Kationen. Diese Metalle sind im Vergleich zu Elementen der Gruppe 1 weniger reaktiv. Darüber hinaus haben diese Elemente höhere Schmelzpunkte im Vergleich zu Elementen der Gruppe 1, und ihre Hydroxide sind vergleichsweise weniger grundlegend.
Was ist der Unterschied zwischen den Elementen der Gruppe 1 und der Gruppe 2?
Die Gruppe 1 und 2 unterscheiden sich je nach Anzahl der Elektronen in ihrem äußersten Orbital voneinander. Der Hauptunterschied zwischen Elementen der Gruppe 1 und der Gruppe 2 besteht darin, dass alle Elemente der Gruppe 1 ungepaarte Elektronen in ihrem äußersten Orbital haben, während Gruppe 2 Elemente Elektronen in ihrem äußersten Orbital gepaart haben.
Die folgende Infografik zeigt mehr Vergleiche bezüglich des Unterschieds zwischen den Elementen der Gruppe 1 und der Gruppe 2.
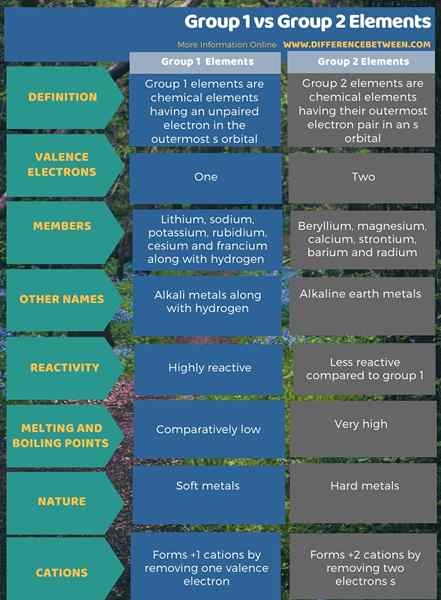
Zusammenfassung -Gruppe 1 gegen Gruppe 2 Elemente
Die Gruppe 1 und 2 unterscheiden sich je nach Anzahl der Elektronen in ihrem äußersten Orbital voneinander. Der Hauptunterschied zwischen Elementen der Gruppe 1 und der Gruppe 2 besteht darin, dass alle Elemente der Gruppe 1 ungepaarte Elektronen in ihrem äußersten Orbital haben, während Gruppe 2 Elemente Elektronen in ihrem äußersten Orbital gepaart haben.
Referenz:
1.„Gruppe 1: Wasserstoff und die Alkali -Metalle.”Chemistry Libretexten, Libretexten, 23. Juni 2019, hier verfügbar.
2. Helmenstine, Anne Marie. „Periodische Tabelle der Elementgruppen.”Thoughtco, Nov. 11, 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Periodenzüchter mit ungepaarten Elektronen" von KES47-SVG-Version aus einem von Sai2020 erstellten JPG-.JPG (Public Domain) über Commons Wikimedia
2. "Schmelzpunkt der Elemente (k)" von Albris - eigene Arbeit (CC BY -SA 4.0) über Commons Wikimedia


