Unterschied zwischen magnetischer Quantenzahl und Spin -Quantenzahl
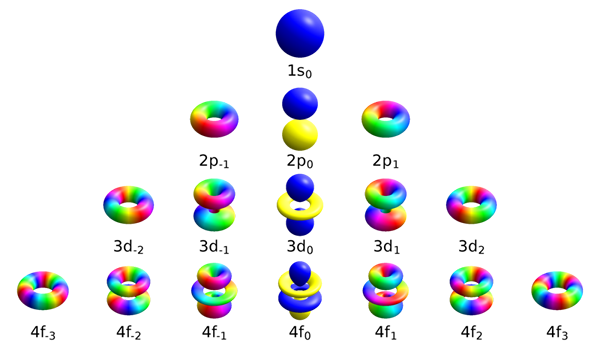
Der Schlüsselunterschied Zwischen magnetischer Quantenzahl und Spinquantenzahl ist das Magnetische Quantenzahl ist nützlich, um Orbitale zu differenzieren, die in Unterschalen verfügbar sind, während die Spinquantenzahl die Energie, Form und Ausrichtung eines Orbitals beschreibt.
Quantenzahlen sind eine Reihe von Werten, die den eindeutigen Quantenzustand eines Elektrons in einem Atom beschreiben. Es gibt vier spezifische Quantenzahlen: Hauptquantennummer, Winkelquantenzahl, magnetische Quantenzahl und Spin -Quantenzahl.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist magnetische Quantenzahl
3. Was ist Spin -Quantenzahl
4. Seite für Seitenvergleich -Magnetische Quantenzahl gegen Spinquantenzahl in tabellarischer Form
5. Zusammenfassung
Was ist magnetische Quantenzahl?
Magnetische Quantenzahl unterscheidet Orbitale, die in Unterschalen verfügbar sind. Das Symbol für diesen Wert ist mich. Nach ihrer Definition gibt diese Quantenzahl fest. Daher enthalten S-, P-, D- und F -Unterschalen unterschiedliche Orbitalezahlen. Die folgende Tabelle zeigt die Anzahl der in jeder Unterschale vorhandenen Orbitale.
| Unterschale | Werte für die magnetische Quantenzahl | Anzahl der Orbitale |
| S | Mich= 0 | 1 |
| P | Mich= -1,0,+1 | 3 |
| D | Mich= -2, -1,0,+1,+2 | 5 |
| F | Mich= -3, -2, -1,0,+1,+2,+3 | 7 |
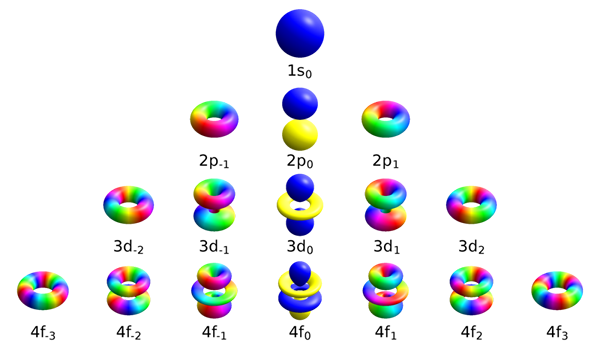
Die magnetische Quantenzahl bestimmt die Energieverschiebung eines Orbitals, das aufgrund des außen aufgebrachten Magnetfelds auftritt. Wir nennen diesen Effekt den „Zeeman -Effekt“. Das tatsächliche magnetische Moment ergibt sich aus zwei Faktoren: Elektronenwinkelmoment und Elektronenspin, die aus der magnetischen Quantenzahl beschrieben werden.
Was ist Spin -Quantenzahl?
Spinquantenzahl beschreibt die Energie, Form und Ausrichtung eines Orbitals. Das Symbol für diesen Wert ist "S". Die Spinquantenzahl ist ein Parameter des intrinsischen Winkelimpulses eines Atoms. Der Spin -Winkelimpuls eines Elektrons in einem Orbital ist als s = 1/2 angegeben.
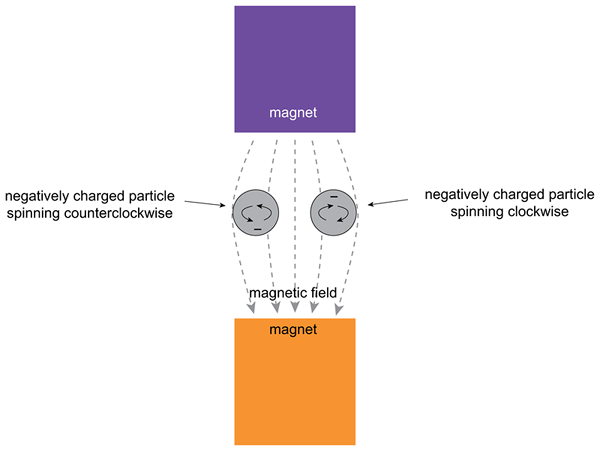
Abbildung 02: Einfluss eines externen Magnetfelds auf ein Elektron
Ein Orbital kann ein Elektronenpaar enthalten; Daher haben die beiden Elektronen S = -1/2 und S =+1/2 Spin-Quantenzahlen. Es bezieht sich auf die Orientierungen „Spin-up“ und „Spin-down“ von Elektronen. Die Quantenzahl gibt den Quantenzustand eines bestimmten Elektrons eines Atoms an. Darüber hinaus können wir eine „Gesamtspin -Quantenzahl“ (en) angeben, die die Spins mehrerer ungepaarter Elektronen einiger bestimmter Atome koppelt.
Was ist der Unterschied zwischen magnetischer Quantenzahl und Spinquantenzahl?
Quantenzahlen sind eine Reihe von Werten, die den eindeutigen Quantenzustand eines Elektrons in einem Atom beschreiben. Der Schlüsselunterschied zwischen der magnetischen Quantenzahl und der Spinquantenzahl besteht darin, dass die magnetische Quantenzahl nützlich ist, um Orbitale in Unterschalen zu unterscheiden, während die Spinquantenzahl die Energie, Form und Orientierung eines Orbitals beschreibt. Die Werte für die magnetische Quantenzahl sind als -l, 0 und +l angegeben. Das Symbol für diesen Wert ist mich. Die Spinquantenzahl ist jedoch als -1/2 und +1/2 angegeben. Das Symbol für diesen Wert ist "S".
Darüber hinaus besteht ein weiterer Unterschied zwischen magnetischer Quantenzahl und Spinquantenzahl darin, dass die magnetische Quantenzahl die Energieverschiebung eines Orbitals beschreibt, das aufgrund des externen Magnetfelds auftritt.
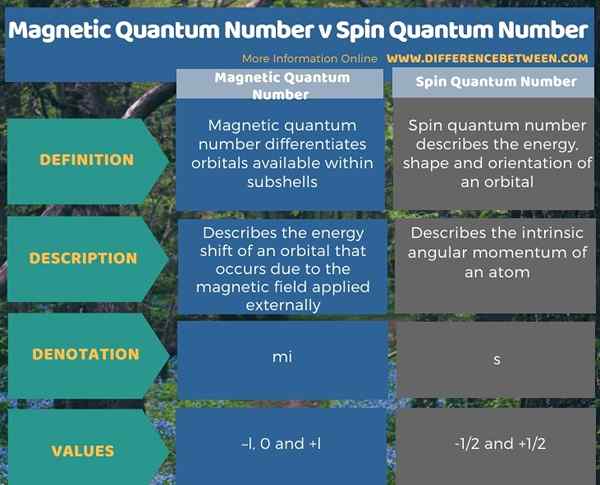
Zusammenfassung -Magnetische Quantenzahl gegen Spin -Quantenzahl
Quantenzahlen sind eine Reihe von Werten, die den eindeutigen Quantenzustand eines Elektrons in einem Atom beschreiben. Der Schlüsselunterschied zwischen der magnetischen Quantenzahl und der Spinquantenzahl besteht darin, dass die magnetische Quantenzahl nützlich ist, um Orbitale in Unterschalen zu unterscheiden, während die Spinquantenzahl die Energie, Form und Orientierung eines Orbitals beschreibt.
Referenz:
1. „Quantenzahlen für Atome.Chemie -Libretexten, Libretexten, 27. September. 2019, hier erhältlich.
2. „Magnetische Quantenzahl.Wikipedia, Wikimedia Foundation, 16. November. 2019, hier erhältlich.
3. „Spin -Quantenzahl.”Wikipedia, Wikimedia Foundation, 1. September. 2019, hier erhältlich.
4. Helmenstine, Anne Marie. „Spin Quantenzahldefinition.”Thoughtco, dec. 7, 2018, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Atomic Orbitals SPDF M -Egenstates" von Geek3 - eigene Arbeit, erzeugt mit Wasserstoff 1.1 (CC BY-SA 4.0) über Commons Wikimedia
2. „Zwei negativ geladene Partikel, die sich in einem Magnetfeld drehen“ von CK -12 Foundation - Datei: High School Chemistry.PDF, Seite 280 (CC BY-SA 3.0) über Commons Wikimedia


