Unterschied zwischen Homo und Lumo
Der Schlüsselunterschied Zwischen Homo und Lumo ist das die Homo spendet Elektronen, während der Lumo Elektronen erhält.
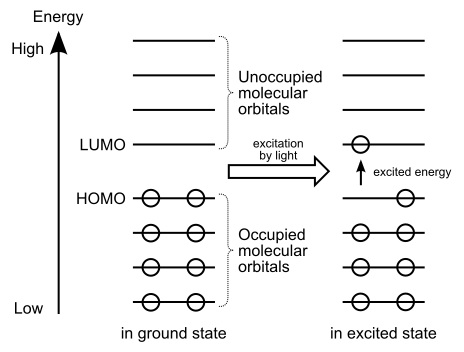
Die Begriffe Homo und Lumo stehen unter der subtopischen „molekularen Orbitalentheorie“ in der allgemeinen Chemie. Der Begriff Homo steht für „höchst besetzte molekulare Orbital“, während der Begriff Lumo für „niedrigste, nicht besetzte molekulare Orbital“ steht. Wir nennen sie "Grenzorbitale". Ein molekulares Orbital liefert die wahrscheinlichste Position eines Elektrons in einem Atom. Molekulare Orbitale bilden sich aus der Kombination von Atomorbitalen von zwei getrennten Atomen, um ihre Elektronen zu teilen. Diese Elektronenfreigabe bildet eine kovalente Bindung zwischen den Atomen. Bei der Bildung dieser molekularen Orbitale teilen sie sich in zwei Formen als Homo und Lumo auf.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Homo
3. Was ist Lumo
4. Seite an Seite Vergleich - Homo vs Lumo in tabellarischer Form
5. Zusammenfassung
Was ist Homo?
Homo steht für das höchste besetzte molekulare Orbital. Die Elektronen in diesen molekularen Orbitalen können an die molekularen Orbitale vom Typ LUMO gespendet werden. Dies liegt daran, dass diese molekularen Orbitale schwach gebundene Elektronen enthalten. Diese molekularen Orbitale sind die am besten verfügbare Form für die kovalente chemische Bindung. Das Vorhandensein dieser molekularen Orbitale ist charakteristisch für nukleophile Substanzen.
Homo hat niedrige Energie. Daher halten Elektronen in diesen molekularen Orbitalen in der Regel; Weil Elektronen versuchen, zuerst in die niedrigen Energieniveaus zu füllen. Deshalb nennen wir sie "besetzte Orbitale". Darüber hinaus können Elektronenanregungen in Gegenwart von Licht Elektronen von Homo nach Lumo spenden.
Was ist Lumo?
LUMO steht für den niedrigsten, nicht besetzten molekularen Orbital. Diese molekularen Orbitale können Elektronen von Homo empfangen. Wie der Name schon sagt, sind diese Orbitale nicht besetzt; Enthält also keine Elektronen. Dies liegt daran. Abgesehen davon sind diese molekularen Orbitale für elektrophile Substanzen charakteristisch.

Abbildung 01: Die Elektronenübertragung von Homo nach Lumo
Wenn wir leichte Energie liefern, können die Elektronen von Homo aufgeregt und nach Lumo ziehen. Deshalb sagen wir, dass Lumo Elektronen erhalten kann.
Was ist der Unterschied zwischen Homo und Lumo?
HOMO steht für das höchste besetzte molekulare Orbital, während der Begriff LUMO für das niedrigste, nicht besetzte molekulare Orbital steht. Beide Formen von Orbitalen sind für die kovalente chemische Bindung wichtig, insbesondere bei der Bildung von PI -Bindungen. Als Hauptunterschied zwischen Homo und Lumo können wir sagen, dass der Homo Elektronen spenden kann, während der Lumo Elektronen empfangen kann. Darüber hinaus ist das Vorhandensein von Homo für Nucleophile charakteristisch, während das Vorhandensein von LUMO für Elektrophile charakteristisch ist.
Die folgende Infografik enthält weitere Details zu dem Unterschied zwischen Homo und Lumo.
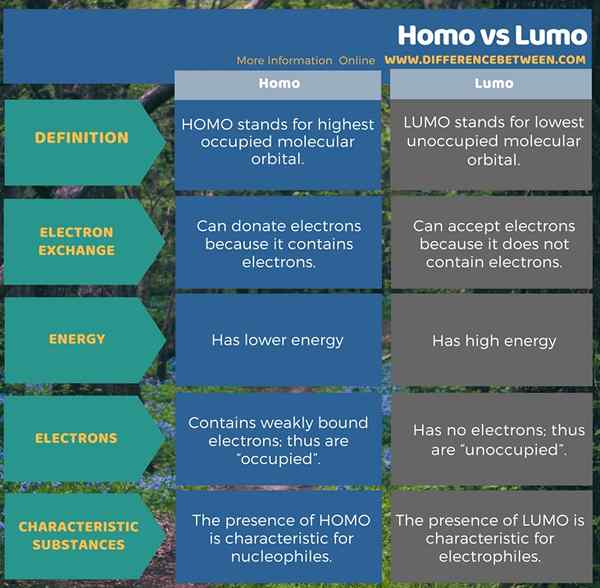
Zusammenfassung -Homo gegen Lumo
Die Grenzmolekülorbitalentheorie erklärt die Bildung von Molekülorbitalen vom Typ Homo und LUMO. Obwohl es mehrere Unterschiede zwischen diesen beiden Typen gibt, besteht der Hauptunterschied zwischen Homo und Lumo darin, dass Homo Elektronen spendet, während Lumo Elektronen erhält.
Referenz:
1. Hunt, Ian R. „Ch 10: Einführung in die MO -Theorie.CH 13 - NMR -Grundlagen. Hier verfügbar
2. „Einführung in die molekulare Orbitalentheorie.”Säure_Base -Indikatoren, Henry Rzepa. Hier verfügbar
Bild mit freundlicher Genehmigung:
1."Molekül Homo-Lumo Diagramm" von Tomgally (Public Domain) über Commons Wikimedia


