Unterschied zwischen Hydrofluorsäure und Salzsäure

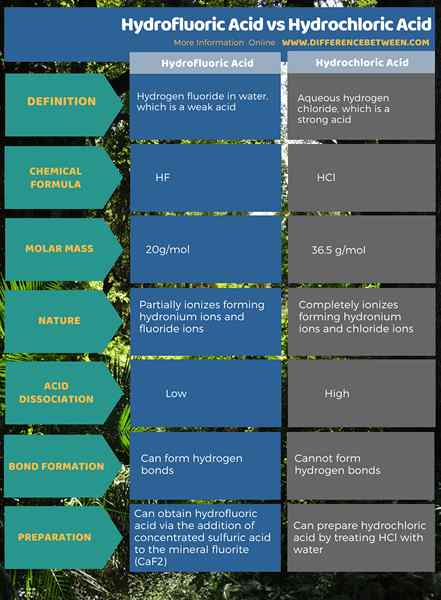
Der Schlüsselunterschied zwischen Hydrofluorsäure und Salzsäure ist, dass die Hydrofluorsäure ist eine schwache Säure, während die Salzsäure eine starke Säure ist. Außerdem kann die Hydrofluorsäure Wasserstoffbrückenbindungen bilden, während die Salzsäure nicht in der Lage ist, Wasserstoffbrückenbindungen zu bilden.
Darüber hinaus liegt ein weiterer wichtiger Unterschied zwischen Hydrofluorsäure und Salzsäure in ihrer molekularen Struktur. Der Das Hydrofluorsäuremolekül hat ein Fluoridion, während das Salzsäuremolekül ein Chloridion aufweist. Darüber hinaus sind sowohl Hydrofluorik- als auch Salzsäure Protonenspender. Daher können diese Säuremoleküle in wässrigen Medien ionisieren, die Protonen freisetzen (H)+). Diese Protonen verursachen die Säure im wässrigen Medium.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Hydrofluorsäure
3. Was ist Salzsäure
4. Seite für Seitenvergleich - Hydrofluorsäure gegen Salzsäure in tabellarischer Form
5. Zusammenfassung
Was ist Hydrofluorsäure?
Hydrofluorsäure ist Wasserstofffluorid im Wasser. Wasserstofffluorid ist eine saure Verbindung mit der chemischen Formel HF und der Molmasse 20 g/mol. Darüber hinaus ist diese Säure eine Startverbindung für fast alle fluorhaltigen Verbindungen. Beispiel: Teflon. Diese Säure ist hoch reaktiv mit Glas und reaktiv mit Metallen. Daher wird es in Plastikbehältern gespeichert. Ein Behälter aus Teflon ist jedoch für diese Säure leicht durchlässig.

Abbildung 01: Eine Flasche Hydrofluorsäure
Hydrofluorsäure ist eine schwache Säure. Das liegt daran, dass es eine niedrigere Dissoziationskonstante hat. Die Dissoziation dieser Säure ergibt Hydroniumionen (Kombination von Protonen und Wassermolekülen bilden Hydroniumionen) und Fluoridionen. Unter den Hydrohalsäuren ist dies die einzige schwache Säure. Wir können diese Säure über die Zugabe von konzentrierter Schwefelsäure zum Mineralfluorit (CAF2) erhalten (CAF2).
Was ist Salzsäure?
Salzsäure ist ein wässriges Wasserstoffchlorid. Wasserstoffchlorid hat die chemische Formel HCl und seine Molmasse 36.5 g/mol. Diese Säure hat einen scharfen Geruch. Darüber hinaus ist es als Startverbindung für viele anorganische Chemikalien wie Vinylchlorid wichtig.

Abbildung 02: Eine Flasche Salzsäure
Im Gegensatz zu HF ist HCL eine starke Säure, die im wässrigen Medium vollständig ionisieren kann und Hydroniumionen und Chloridionen bildet. Somit hat diese Säure einen hohen KA -Wert. Wir können diese Säure vorbereiten, indem wir HCL mit Wasser behandeln.
Was ist der Unterschied zwischen Hydrofluorsäure und Salzsäure?
Hydrofluorsäure ist Wasserstofffluorid im Wasser. Es ist eine schwache Säure und kann Wasserstoffbrückenbindungen bilden. Salzsäure ist wässriges Wasserstoffchlorid. Es ist eine starke Säure und kann keine Wasserstoffbrückenbindungen bilden. Dies ist der Hauptunterschied zwischen Hydrofluorsäure und Salzsäure.
Darüber hinaus hat das Hydrofluorsäuremolekül ein Fluoridion, während das Salzsäuremolekül ein Chloridion aufweist. Beide sind jedoch Hydrohalsäuren mit einem Wasserstoffatom, das an einen Halogen gebunden ist. Darüber hinaus ist die Hydrofluorsäure die einzige schwache Säure unter anderen Hydrohalsäuren.
Zusammenfassung -Hydrofluorsäure gegen Salzsäure
Hydrofluorik und Salzsäure sind Hydrohalsäuren, da beide Säureverbindungen ein Halogenid auf ein Wasserstoffatom haben. Darüber hinaus gibt es viele Unterschiede zwischen diesen beiden Säuren. Der Unterschied zwischen Hydrofluorsäure und Salzsäure besteht darin, dass die Hydrofluorsäure eine schwache Säure ist und Wasserstoffbrückenbindungen bilden kann.
Referenz:
1. "Fluorwasserstoffsäure.Nationales Zentrum für Biotechnologieinformationen. Pubchem Compound -Datenbank, u.S. Nationalbibliothek für Medizin. Hier verfügbar
2. "Salzsäure.Nationales Zentrum für Biotechnologieinformationen. Pubchem Compound -Datenbank, u.S. Nationalbibliothek für Medizin. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.'Wasserstofffluorid'by-Benutzer: Dorgan-selbstfotografiert (CC BY-SA 3).0) über Commons Wikimedia
2.'Salzsäure 05' (Public Domain) über Commons Wikimedia


