Unterschied zwischen Hyperkonjugation und Resonanz
Schlüsselunterschied - Hyperkonjugation gegen Resonanz
Hyperkonjugation und Resonanz können polyatomische Moleküle oder Ionen auf zwei verschiedene Arten stabilisieren. Die Anforderungen für diese beiden Prozesse sind unterschiedlich. Wenn ein Molekül mehr als eine Resonanzstruktur haben kann, besitzt dieses Molekül die Resonanzstabilisierung. Eine Hyperkonjugation tritt jedoch in Gegenwart eines σ-Bindes mit einem angrenzenden leeren oder teilweise gefüllten p-Orbital oder einem π-Orbital auf. Dies ist das Schlüsselunterschied Hyperkonjugation und Resonanz
Was ist Hyperkonjugation?
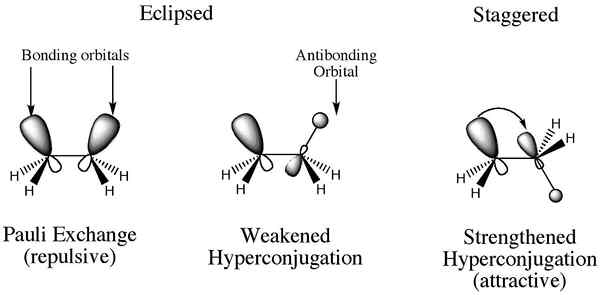
Die Wechselwirkung von Elektronen in einem σ-Bindungen (im Allgemeinen C-H- oder C-C-Bindungen) mit einem benachbarten leeren oder teilweise gefüllten p-Orbital oder einem π-Orbital führt zu einem erweiterten molekularen Orbital, indem die Stabilität des Systems erhöht wird. Diese Stabilisierungsinteraktion wird als "Hyperkonjugation" bezeichnet. Nach der Valenz -Bond -Theorie wird diese Wechselwirkung als "Doppelbindung ohne Bindungsresonanz" beschrieben.

Schreiner Hyperconjugation
Was ist Resonanz?
Resonanz ist die Methode zur Beschreibung delokalisierter Elektronen in einem Molekül oder einem polyatomischen Ion, wenn es mehr als eine Lewis -Struktur haben kann, um das Bindungsmuster auszudrücken. Mehrere beitragende Strukturen können verwendet werden, um diese delokalisierten Elektronen in einem Molekül oder einem Ion darzustellen, und diese Strukturen werden genannt Resonanzstrukturen. Alle beitragenden Strukturen können unter Verwendung einer Lewis -Struktur mit einer zählbaren Anzahl kovalenter Bindungen veranschaulicht werden, indem das Elektronenpaar zwischen zwei Atomen in der Bindung verteilt wird. Da können mehrere Lewis -Strukturen verwendet werden, um die molekulare Struktur darzustellen. Die tatsächliche molekulare Struktur ist ein Intermediat all dieser möglichen Lewis -Strukturen. Es heißt a Resonanzhybrid. Alle beitragenden Strukturen haben die Kerne in derselben Position, aber die Verteilung der Elektronen kann unterschiedlich sein.
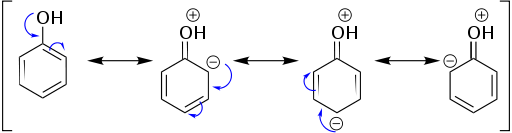
Phenolresonanz
Was ist der Unterschied zwischen Hyperkonjugation und Resonanz?
Merkmale der Hyperkonjugation und Resonanz
Hyperkonjugation
- Hyperkonjugation beeinflusst die Bindungslänge und führt zur Verkürzung von Sigma -Bindungen (σ -Bindungen).
| Molekül | C-C-Bindungslänge | Grund |
| 1,3-Butadien | 1.46 a | Normale Konjugation zwischen zwei Alkenylteilen. |
| Methylacetylen | 1.46 a | Hyperkonjugation zwischen Alkyl- und Alkinyl -Teilen |
| Methan | 1.54 a | Es ist ein gesättigter Kohlenwasserstoff ohne Hyperkonjugation |
- Moleküle mit Hyperkonjugation haben höhere Werte für die Bildungswärme im Vergleich zur Summe ihrer Bindungssenergien. Aber die Hydrierungswärme pro Doppelbindung ist geringer als die von Ethylen.
- Die Stabilität von Karbokationen variiert je nach Anzahl der C-H-Bindungen, die an das positiv geladene Kohlenstoffatom gebunden sind. Die Hyperkonjugationsstabilisierung ist größer, wenn viele C-H-Bindungen angebracht sind.
(CH3)3C+ > (Ch3)2CH+ > (Ch3)CH2+ > Ch3+
- Die relative Hyperkonjugationsstärke hängt vom Isotopentyp des Wasserstoffs ab. Wasserstoff hat eine größere Stärke im Vergleich zu Deuterium (D) und Tritium (T). Tritium hat die geringste Fähigkeit, eine Hyperkonjugation unter ihnen zu zeigen. Die Energie, die erforderlich ist, um eine C-T-Bindung> C-D-Bindung zu brechen.
Resonanz
- Mehrere Lewis -Strukturen können verwendet werden, um die Struktur darzustellen, aber die tatsächliche Struktur ist ein Zwischenprodukt dieser Strukturen und wird durch einen Resonanzhybrid dargestellt.
- Die Resonanzstrukturen sind keine Isomere. Diese Resonanzstrukturen unterscheiden sich nur in der Position von Elektronen, jedoch nicht in der Position der Kerne.
- Jede Lewis -Struktur hat eine gleiche Anzahl von Valenz- und ungepaarten Elektronen, und dies führt zu der gleichen Ladung in jeder Struktur.
- Die tatsächliche Struktur besitzt eine niedrigere Gesamtpotentialergie im Vergleich zum geschätzten Wert der beitragenden Strukturen. Daher liefert Moleküle/Ionen mit einem Resonanzhybrid eine zusätzliche Stabilisierung für das jeweilige Molekül/Ion.


