Unterschied zwischen isotonisch und hypertonisch
Schlüsselunterschied - isotonische gegen Hypertonische
Es ist wichtig, das Konzept der Tonizität zu verstehen, bevor der Unterschied zwischen isotonisch und hypertonisch analysiert wird. Lassen Sie uns daher zunächst kurz das Konzept der Tonizität und seine Bedeutung beschreiben. Die Tonizität ist die Varianz der Wasserkonzentration von zwei Lösungen geteilt durch eine semipermeable Membran. Es kann auch als relative Wasserkonzentration von Lösungen erklärt werden. Durch die Identifizierung der Tonizität von Lösungen können wir bestimmen, in welcher Richtung Wasser diffundieren wird. Dieses Phänomen wird üblicherweise verwendet, wenn die Reaktion von Zellen in einer externen Lösung veranschaulicht. Es gibt drei Klassifikationen der Tonizität, die eine Lösung in Bezug auf eine andere haben kann.Sie sind hypertonisch, hypotonisch und isotonisch. Der Schlüsselunterschied Zwischen isotonisch und hypertonisch ist das Die hypertonische Lösung enthält mehr Lösungsmittel als gelöste Stoffe wohingegen Der gelöste Stoff und das Lösungsmittel sind gleichermaßen in der isotonischen Lösung verteilt. Das Auswendiglernen der Definition von hypertonischen und isotonischen Lösungen ist jedoch nicht wichtig, wenn wir den Unterschied zwischen isotonischen und hypertonischen Lösungen verstehen können.
Was ist hypertonisch?
Hyper ist ein weiteres Wort für oben oder übermäßig. Hypertonische Lösungen haben eine höhere Konzentration an gelösten Stoff (Glucose oder Salz) als die Zelle. Gelöste Stoffe sind die Elemente, die in einem Lösungsmittel aufgelöst werden und dadurch eine Lösung bilden. In einer hypertonischen Lösung ist die Konzentration der gelösten Stoffe außerhalb der Zelle größer als darin. Wenn eine Zelle in eine hypertonische Lösung eintaucht, wird eine osmotische Verschiebung und Wassermoleküle aus der Zelle fließen.
Was ist isotonisch?
ISO ist ein weiteres Wort für Gleicher und Tonic für die Tonizität der Lösung. Isotonische Lösungen haben eine ähnliche Konzentration an gelösten Stoff als die Lösung, mit der sie verglichen wird. In einer isotonischen Lösung ist die Konzentration von gelösten Stoffen sowohl innerhalb als auch außerhalb der Zelle gleicher. Wenn eine Zelle in eine isotonische Lösung eintaucht. Dieser Prozess erzeugt keine Schwellung oder Schrumpfung der Zelle.
Was ist der Unterschied zwischen isotonisch und hypertonisch?
Die Unterschiede zwischen hypertonisch und isotonisch können in folgende Kategorien eingeteilt werden.
Definition von Isotonisch und hypertonisch
Hypertonisch: "Hyper" ist als obiger oder übermäßiges + "Tonic" bekannt als etwas in der Reihe einer Lösung. Daher deutet eine Hypertonische eine erhöhte Tonizität der Lösung vor.
Isotonisch: "ISO" ist alselbe + "Tonic" bekannt als etwas in der Reihe einer Lösung. Daher weist Isotonikon eine ähnliche Tonizität der Lösung vor.
Eigenschaften von Isotonisch und hypertonisch
Konzentration von gelösten Stoff und Lösung
Hypertonisch: Die Lösung enthält mehr Lösungsmittel als gelösten Stoff.
Isotonisch: Gelöste und lösungsmittel in der Lösung werden gleich verteilt.
Beispiele
Hypertonisch: Gereinigtes Wasser, da kein/weniger gelöster gelöster Stoff im gereinigten Wasser gelöst ist und seine Konzentration im Vergleich zur zellulären Umgebung sehr niedrig ist.
Isotonisch: Kochsalzlösung ist ein isotonisches Plasma des menschlichen Blutes
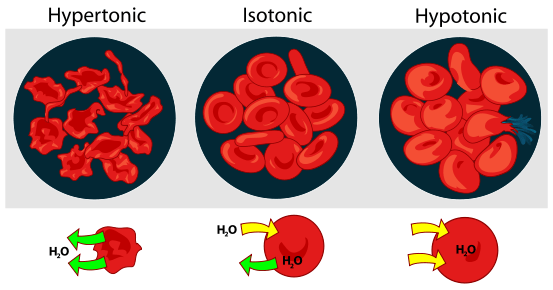
Zellenantwort in hypertonischer und isotonischer Lösung (Siehe Abbildung 1)
Hypertonisch: Wenn eine biologische Zelle in einer hypertonischen Umgebung ist. Infolgedessen die Zelle schrumpft Wenn Wasser die Zelle verlässt, um die höhere Konzentration des gelösten Stoffes in der äußeren Umgebung zu verringern.
Isotonisch: Wenn sich eine Zelle in einer isotonischen Lösung befindet, wird keine Schwellung oder Verkleinerung der Zelle erzeugt.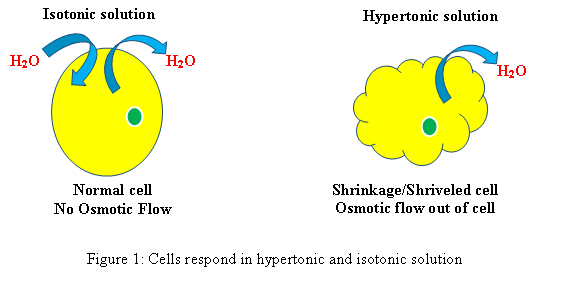
Wasserkonzentrationsgradient
Hypertonisch: Wasserkonzentrationsgradient kann von der Innenseite der Zelle bis zur hypertonischen Lösung beobachtet werden
Isotonisch: Wasserkonzentrationsgradienten existiert nicht
Konzentrationsgradient der gelösten Stoffe
Hypertonisch: Der Konzentrationsgradient der gelösten Stoffe wird von der hypertonischen Lösung bis hin zu Innenseite der Zelle beobachtet
Isotonisch: Der Konzentrationsgradient der gelösten Stoffe existiert nicht.
Osmotische Verschiebung
Hypertonisch: Osmotische Verschiebung gibt es.
Isotonisch: Osmotische Verschiebung gibt es nicht
Wasserbewegung
Hypertonisch: Wassermoleküle bewegen sich oder diffundieren schnell von innen der Zelle zu äußeren Lösungsrichtungen, und somit verliert die Zelle Wasser.
Isotonisch: Wassermoleküle bewegen sich oder diffundieren in beide Richtungen, und die Wasserdiffusionsrate ist in jeder Richtung ähnlich. Somit wird die Zelle Wasser entweder erhalten oder verlieren.
Sportgetränke
Isotonisch: Ein isotonisches Getränk umfasst ähnliche Konzentrationen an Salz, Zuckerkohlenhydrat und Elektrolyten wie im menschlichen Körper. Isotonisches Sportgetränk wird oft als orale Rehydratisierungslösung bevorzugt. Es hat normalerweise 4-8 g Kohlenhydrat pro 100 ml.
Hypertonisch: Hypertonisches Getränk umfasst höhere Konzentrationen an Salz, Zuckerkohlenhydrat und Elektrolyten wie im menschlichen Körper. Es hat normalerweise ungefähr 8 g Kohlenhydrat pro 100 ml. Eine hypertonische Lösung wird auch in der Osmotherapie verwendet, um zerebrale Blutungen zu behandeln. Hypertonische Sportgetränke sind ideal für diejenigen, die ein sehr hohes Maß an Energie benötigen.
Zusammenfassend lässt sich sagen. Die Konzentration von gelösten Stoffen ist sowohl innerhalb als auch außerhalb der Zelle in einer isotonischen Lösung gleich. Die Konzentration von gelösten gelösten ist innerhalb der Zelle größer als die äußere Umgebung in einer hypotonischen Lösung, während die hypertonische Lösung eine ist.
Referenzen Mansoor, m. A., Beverly, j., und Sandmann. (2002). Angewandte physische Apotheke. McGraw-Hill Professional. pp. 54-57. Voet, d., Judith, g. V. und Charlotte, w. P. (2001). Grundlagen der Biochemie (Rev.ed.). New York: Wiley. P.30. Bild mit freundlicher Genehmigung: „Osmotischer Druck auf Blutzellendiagramm“ von Ladyofhats - hat es selbst auf [1], [2], [3] und [4]… (öffentlich) über Wikimedia Commons selbst basiert


