Unterschied zwischen KD und KM
Schlüsselunterschied - KD gegen KM
KD und KM sind Gleichgewichtskonstanten. Der Hauptunterschied zwischen KD und KM ist das KD ist eine thermodynamische Konstante, während km keine thermodynamische Konstante ist.
KD bezieht sich auf die Dissoziationskonstante, während KM die Michaelis -Konstante ist. Beide Konstanten sind bei der quantitativen Analyse enzymatischer Reaktionen sehr wichtig.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist KD
3. Was ist KM
4. Seite an Seitenvergleich - KD vs KM in tabellarischer Form
5. Zusammenfassung
Was ist KD?
KD ist die Dissoziationskonstante. Es ist auch als bekannt als Gleichgewichtsdissoziationskonstante Aufgrund seiner Verwendung in Gleichgewichtssystemen. Die Dissoziationskonstante ist die Gleichgewichtskonstante von Reaktionen, bei denen eine große Verbindung reversibel in kleine Komponenten umgewandelt wird. Der Prozess dieser Umwandlung wird auch als Dissoziation bezeichnet. Ein ionisches Molekül dissoziiert sich immer in seine Ionen. Dann ist die Dissoziationskonstante oder KD eine Menge. Dies entspricht daher dem Produkt der Konzentrationen der jeweiligen Ionen, geteilt durch die Konzentration des nicht dissoziierten Moleküls.
Ab ↔ a +b
In der obigen allgemeinen Reaktion, die Dissoziationskonstante, kann KD wie unten angegeben werden.
Kd = [a] [b] / [ab].
Wenn es eine stöchiometrische Beziehung gibt, sollte man die stöchiometrischen Koeffizienten in die Gleichung einbeziehen.
xab ↔ aa +bb
Die Gleichung der Dissoziationskonstante, KD für die obige Reaktion, lautet wie folgt:
Kd = [a]A[B]B / [Ab]X
Insbesondere in biochemischen Anwendungen hilft KD, die Menge der Produkte zu bestimmen, die durch eine chemische Reaktion in Gegenwart eines Enzyms angegeben sind. Der KD einer enzymatischen Reaktion exprimiert die Ligand-Rezeptor-Affinität. Mit anderen Worten, es gibt die Fähigkeit eines Substrats an, den Rezeptor eines Enzyms zu verlassen. Andererseits beschreibt es, wie stark ein Substrat an das Enzym bindet.
Was ist KM?
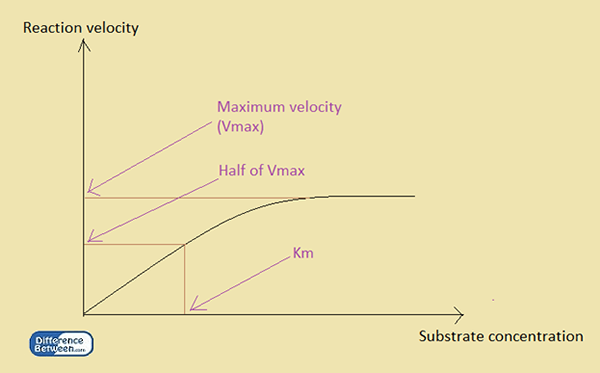
KM ist die Michaelis -Konstante. Im Gegensatz zu KD ist KM eine kinetische Konstante. Die Hauptanwendung ist in der Enzymkinetik, dh die Affinität eines Substrats zu bestimmen, um sie mit einem Enzym zu binden. Die Konstante wird durch die Beziehung der Substratkonzentration in Gegenwart eines Enzyms exprimiert. Dementsprechend ist die Michaelis -Konstante oder km die Konzentration des Substrats, wenn die Reaktionsgeschwindigkeit die Hälfte seiner maximalen Geschwindigkeit erreicht.

Abbildung 1: Die Beziehung zwischen Reaktionsgeschwindigkeit und Substratkonzentration in einer enzymatischen Reaktion.
Während einer Reaktion zwischen Enzym (E) und Substrat (S) ist die Bildung von Produkten (P) wie folgt:
E + S ↔ E-S-Komplex ↔ e + p
Wenn die Gleichgewichtskonstanten der obigen Reaktion wie folgt sind, können Sie KM von diesen Konstanten ableiten.
Km = k-1 + K+2 /K+1
Bestimmung von KM nach Michaels Konzept
Michaelis entwickelte eine Beziehung unter Verwendung der Konzentration von Substrat, [S] und der maximalen Reaktionsgeschwindigkeit Vmax. Die Beziehung zwischen Substratkonzentration und km einer enzymatischen Reaktion ist wie folgt:
v = vmax [s] / km + [s]
V ist zu jeder Zeit Geschwindigkeit, während [s] die Substratkonzentration zu einem bestimmten Zeitpunkt ist, und Vmax ist die maximale Geschwindigkeit der Reaktion. KM ist die Michaelis -Konstante für das Enzym in der Reaktion. Der Wert der Michaelis -Konstante hängt vom Enzym ab. Folglich zeigt ein kleiner Wert von km an, dass das Enzym mit einer geringen Menge an Substrat gesättigt wird. Dann wird der VMAX bei einer niedrigen Substratkonzentration erhalten. Im Gegensatz dazu zeigt ein hoher KM -Wert an, dass das Enzym eine hohe Menge an Substrat benötigt, um gesättigt zu werden.
Was ist der Unterschied zwischen KD und KM?
KD gegen KM | |
| KD ist die Dissoziationskonstante. | KM ist die Michaelis -Konstante. |
| Natur | |
| KD ist eine thermodynamische Konstante. | KM ist eine kinetische Konstante. |
| Einzelheiten | |
| KD repräsentiert die Affinität eines Substrats zu einem Enzym. | Km repräsentiert die Beziehung zwischen Substratkonzentration und Reaktionsgeschwindigkeit. |
Zusammenfassung - KD gegen KM
KD und KM sind Gleichgewichtskonstanten, die Eigenschaften enzymatischer Reaktionen beschreiben. Der Schlüsselunterschied zwischen KD und KM besteht darin, dass KD eine thermodynamische Konstante ist, während KM keine thermodynamische Konstante ist.
Referenz:
1. „Michaelis-Menten-Kinetik.”Wikipedia, Wikimedia Foundation, 10 April. 2018, hier erhältlich.
2. „Einführung in Enzyme.Substratkonzentration (Einführung in Enzyme), hier verfügbar.
3. "Dissoziationskonstante.”Wikipedia, Wikimedia Foundation, 10 April. 2018, hier erhältlich.


