Unterschied zwischen molarer Löslichkeit und Produktlöslichkeitskonstante

Der Schlüsselunterschied zwischen molarer Löslichkeit und Produktlöslichkeitskonstante ist, dass die Die molare Löslichkeit beschreibt die Auflösung einer Substanz pro Liter einer Lösung, während die Produktlöslichkeitskonstante die Auflösung einer festen Substanz in einer wässrigen Lösung beschreibt.
Sowohl molare Löslichkeit als auch Produktlöslichkeitskonstante sind chemische Konzepte, die die Auflösung von Substanzen in Lösungen beschreiben. Wir können die molare Löslichkeit aus der Produktlöslichkeitskonstante berechnen. Daher sind sie miteinander verwandt.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist molare Löslichkeit
3. Was ist Produktlöslichkeitskonstante
4. Seite für Seitenvergleich - Molare Löslichkeit und Produktlöslichkeit Konstante in tabellarischer Form
5. Zusammenfassung
Was ist molare Löslichkeit?
Die molare Löslichkeit ist die Anzahl der Mol einer Substanz, die sich vor der Sättigung pro Liter einer Lösung auflöst. Das bedeutet; Die molare Löslichkeit gibt die Menge einer Substanz, die wir in einer Lösung auflösen können. Wir können diese Menge anhand der Produktlöslichkeitskonstante oder der KSP und der Stöchiometrie berechnen. Die Einheit für die molare Löslichkeit ist mol/l. Wir können diesen Begriff als „M“ bezeichnen. Wir können die molare Löslichkeit mit KSP berechnen, müssen jedoch die durch die Dissoziation während der Auflösung der Substanz in der Lösung erzeugten Ionen kennenlernen.

Betrachten wir ein Beispiel; Wenn AB in einer wässrigen Lösung gelöst ist, dissoziiert es in A- und B -ionische Produkte. Die Gleichung für diese Auflösung lautet wie folgt:
Ab(S) ⇌ a(aq) + B(aq)
Nach der Stöchiometrie dieser Reaktion ist die Endkonzentration von B auch "x", wenn die Endkonzentration von A "x" ist, auch "x" ist, auch "x", auch "x" ist, sondern auch "x", auch "x" ist. Dann ist die Löslichkeitsproduktgleichung für diese Reaktion;
Ksp = [a] [b]
= [x] [x]
= x2
Hier ist X die molare Löslichkeit. Wenn wir den KSP der Reaktion kennen, können wir daher die x -molare Löslichkeit der Reaktion berechnen.
Was ist Produktlöslichkeitskonstante?
Produktlöslichkeitskonstante oder Löslichkeitsproduktkonstante ist die Gleichgewichtskonstante für die Auflösung einer festen Substanz in einer wässrigen Lösung. Daher beschreibt es die Auflösung einer festen Substanz in einer wässrigen Lösung und repräsentiert den Niveau, auf dem sich ein gelöster Stoff in einer Lösung auflöst. Wir können es als KSP bezeichnen. Im Allgemeinen wird KSP berechnet, indem die Konzentrationen ionischer Produkte nach der Auflösung der Substanz multipliziert werden. Für die Auflösung von AB2, Die Reaktion ist wie folgt:
Ab2 (s) ⇌ a(aq) + 2B(aq)
Für die obige Reaktion lautet die Produktlöslichkeitskonstante oder KSP wie folgt:
Ksp = [a(aq)][B(aq)]2
Was ist der Unterschied zwischen molarer Löslichkeit und Produktlöslichkeitskonstante?
Sowohl die molare Löslichkeit als auch die Produktlöslichkeitskonstante beschreiben die Auflösung einer Substanz in einer Lösung. Der Schlüsselunterschied zwischen molarer Löslichkeit und Produktlöslichkeitskonstante besteht jedoch darin, dass die molare Löslichkeit die Auflösung einer Substanz pro Liter einer Lösung beschreibt, während die Produktlöslichkeitskonstante die Auflösung einer festen Substanz in einer wässrigen Lösung beschreibt.
Außerdem ist die molare Löslichkeit die Anzahl der Mol einer Substanz, die sich vor der Sättigung pro Liter einer Lösung auflöst. In der Zwischenzeit ist die Produktlöslichkeitskonstante oder Löslichkeitsproduktkonstante die Gleichgewichtskonstante für die Auflösung einer festen Substanz in einer wässrigen Lösung. Wir können die molare Löslichkeit als „M“ und Produktlöslichkeitskonstante als „KSP“ bezeichnen.
Die folgende Infografik fasst den Unterschied zwischen molarer Löslichkeit und Produktlöslichkeitskonstante zusammen.
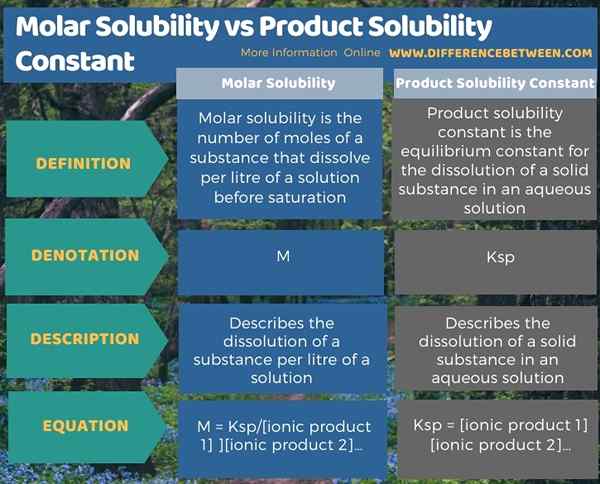
Zusammenfassung -molare Löslichkeit gegen Produktlöslichkeitskonstante
Zusammenfassend beschreiben sowohl die molare Löslichkeit als auch die Produktlöslichkeitskonstante die Auflösung einer Substanz in einer Lösung. Der Schlüsselunterschied zwischen molarer Löslichkeit und Produktlöslichkeitskonstante besteht jedoch darin, dass die molare Löslichkeit die Auflösung einer Substanz pro Liter einer Lösung beschreibt, während die Produktlöslichkeitskonstante die Auflösung einer festen Substanz in einer wässrigen Lösung beschreibt.
Referenz:
1. „Löslichkeitsproduktkonstante, KSP.”Chemistry Libretexten, Libretexte, 5. Juni 2019, hier erhältlich.
2. „Molare Löslichkeit.”Wikipedia, Wikimedia Foundation, 5. April. 2019, hier erhältlich.
3. „Löslichkeitsgleichgewicht.”Wikipedia, Wikimedia Foundation, 26. September. 2019, hier erhältlich.


