Unterschied zwischen organischer Säure und anorganischer Säure
Der Schlüsselunterschied zwischen organischer Säure und Anorgansäure ist das Organische Säuren enthalten im Wesentlichen Kohlenstoffhydrogenbindungen in ihrer Struktur, während anorganische Säuren Kohlenstoff enthalten können oder nicht.
Säuren werden auf verschiedene Arten von verschiedenen Wissenschaftlern definiert. Unabhängig von diesen unterschiedlichen Definitionen identifizieren wir normalerweise eine Säure als Protonenspender. Säuren haben einen sauren Geschmack. Limettensaft und Essig sind zwei Säuren, die wir normalerweise in unseren Häusern sehen. Sie reagieren mit Basen und produzieren Wasser; Sie reagieren auch mit Metallen, um H zu bilden2, Erhöhung der Metallkorrosionsrate. Säuren können basierend auf ihrer Fähigkeit, Protonen zu dissoziieren und zu produzieren, in zwei Gruppen eingeteilt werden. Starke Säuren sind in einer Lösung vollständig ionisiert, um Protonen zu ergeben. Schwache Säuren teilweise dissoziiert und geben weniger Mengen an Protonen. Darüber hinaus können wir Säuren als organische und anorganische Säuren kategorisieren.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist organische Säure
3. Was ist anorganische Säure
4. Seite an Seitenvergleich - organische Säure gegen Anorganinsäure in tabellarischer Form
5. Zusammenfassung
Was ist organische Säure?
Organische Säuren sind organische Verbindungen, die als Säuren wirken können. Organische Säuren enthalten im Wesentlichen Wasserstoff und Kohlenstoff mit einem anderen Element/s. Die meisten häufigen organischen Säuren sind Essigsäure, Milchsäure, Zitronensäure, Ameisensäure usw. Diese Säuren haben eine -kooh -Gruppe.
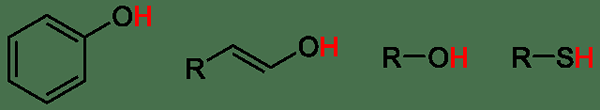
Abbildung 01: Schwache organische Säuren
Manchmal können organische Verbindungen mit -OH -SH -Gruppen auch als Säuren wirken. Zum Beispiel haben Alkohole saure Eigenschaften. Acetylen kann auch ein Proton spenden, das saure Eigenschaften zeigt. Die an Alpha -Kohlenstoff der Aldehyde gebundenen Wasserdauer und Ketone sind ebenfalls saure Protonen. Oft sind organische Säuren schwache Säuren und dissozieren teilweise in Wasser.
Was ist anorganische Säure?
Anorganinsäuren sind die sauren Verbindungen, die aus anorganischen Quellen stammen. Ein Synonym für Anorganinsäuren ist Mineralsäuren, und sie stammen aus Mineralquellen.

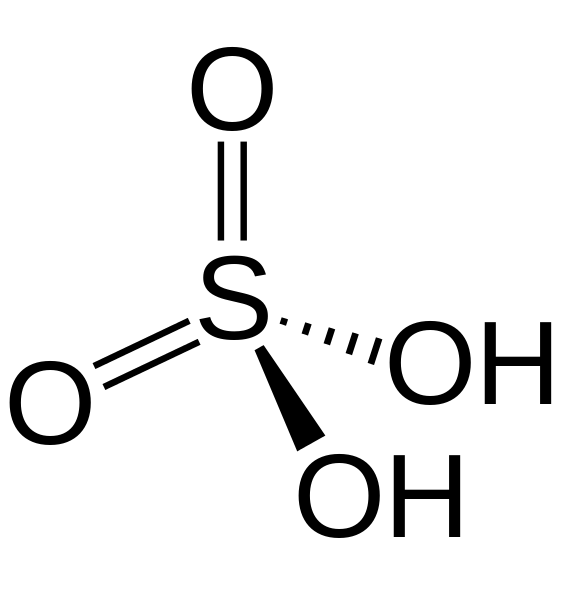
Abbildung 02: Schwefelsäure ist eine anorganische Säure
Anorganinsäuren füllen Protonen frei, wenn sie in Wasser gelöst werden. Es gibt starke Anorganinsäuren wie HCl, HNO3, H2SO4 und schwache Anorganinsäuren wie HCN oder H2S.
Was ist der Unterschied zwischen organischer Säure und anorganischer Säure?
Der Hauptunterschied zwischen organischer Säure und Anorganinsäure besteht darin, dass organische Säuren im Wesentlichen Kohlenstoffhydrogenbindungen in ihrer Struktur enthalten, während Anorganinsäuren möglicherweise Kohlenstoff enthalten oder nicht. Im Allgemeinen sind organische Säuren schwächere Säuren als anorganische Säuren. Die meisten organischen Säuren sind in Wasser unlöslich (manchmal mit Wasser mischbar), aber in organischen Lösungsmitteln löslich. Inorgansäuren sind jedoch im Wasser im Allgemeinen gut löslich und in organischen Lösungsmitteln nicht löslich. Organische Säuren haben einen biologischen Ursprung, während anorganische Säuren nicht der Fall sind. Anorganinsäuren stammen aus anorganischen Verbindungen/Mineralquellen. Darüber hinaus sind Mineralsäuren mit Metallen stark reaktiv und haben korrosive Fähigkeiten als organische Säuren.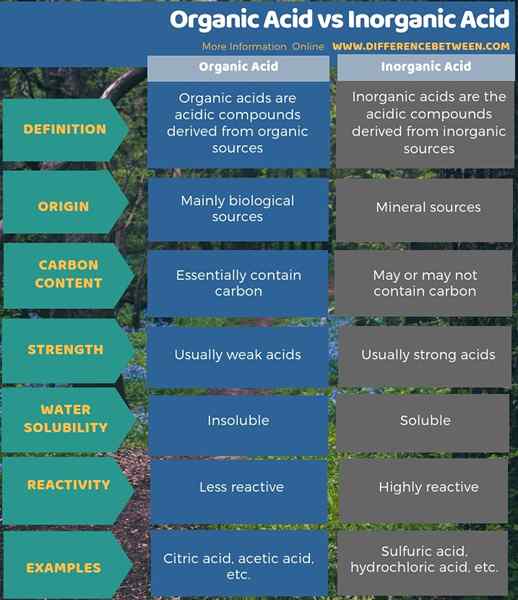
Zusammenfassung -organische Säure gegen anorganische Säure
Säuren können als organische und anorganische Säuren klassifiziert werden. Der Hauptunterschied zwischen organischer Säure und Anorganinsäure besteht darin, dass organische Säuren im Wesentlichen Kohlenstoffhydrogenbindungen in ihrer Struktur enthalten, während Anorganinsäuren möglicherweise Kohlenstoff enthalten oder nicht.
Referenz:
1. McKenzie, Marian und Virginia Corrigan. „Kartoffelgeschmack.Fortschritte in der Kartoffelchemie und -technologie, 2016, pp. 339-368., doi: 10.1016/B978-0-12-800002-1.00012-1.
Bild mit freundlicher Genehmigung:
1. "Schwache organische Säuren" von HBF878 - eigene Arbeit (CC0) über Commons Wikimedia
2. "Schwefelsäure" von Leyo - eigene Arbeit (Public Domain) über Commons Wikimedia


