Unterschied zwischen pH und poh
Schlüsselunterschied - pH vs poh
Die Begriffe pH und poh werden verwendet, um die Mengen von H auszudrücken+ und oh- Ionen in einer wässrigen Lösung vorhanden. Diese Ausdrücke werden als minus logarithmische Werte der Konzentration des gelösten Stoffes angegeben. PH bezieht sich auf das „Potential von Wasserstoff“. Es kann verwendet werden, um festzustellen, ob eine Lösung sauer, basisch oder neutral ist. Im Gegensatz dazu ist POH ein Maß für das Hydroxidion (OH-) Konzentration. Der Schlüsselunterschied Zwischen PH und Poh ist das pH ist ein Maß für Wasserstoffionen, während POH ein Maß für Hydroxidionen ist.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist pH
3. Was ist poh
4. Beziehung zwischen pH und poh
5. Seite an Seite Vergleich - pH vs poh in tabellarischer Form
6. Zusammenfassung
Was ist pH?
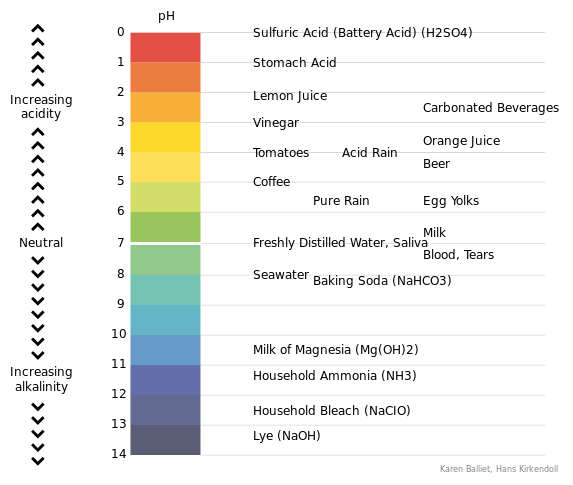
pH ist eine Figur, die die Säure oder Alkalität einer Lösung auf einer logarithmischen Skala ausdrückt, auf der 7 neutral ist. Die Werte unter 7 sind saurer, während höhere Werte alkalischer Werte mehr. Der pH -Wert entspricht –log10 C, wobei C die Wasserstoffionenkonzentration in Mol pro Liter ist.
Die pH -Skala läuft von 1 bis 14. Die pH -Werte 1 bis 6 werden als saure pH -Werte erkannt. Die pH -Werte von 8 bis 14 werden als grundlegende pH -Werte erkannt. Der pH 7 wird als neutraler pH -Wert angesehen. Beispielsweise haben starke Säuren einen pH -Wert in der Nähe von pH = 1, während starke Basen pH -Werte in der Nähe von pH = 14 haben. Das „P“ im Begriff pH bezieht sich auf den negativen Logarithmus. Im Allgemeinen wird der negative Logarithmus der Wasserstoffionenkonzert (oder pH) verwendet, anstatt die Konzentration von Wasserstoffionen zu verwenden. Das liegt daran, dass die Konzentrationen von Wasserstoffionen in den meisten Zeit.

Abbildung 01: pH -Skala
In wässrigen Lösungen dissoziieren die Wassermoleküle in Wasserstoffionen und Hydroxidionen. Daher haben alle natürlichen Gewässer einen bestimmten pH -Wert. Der pH -Wert eines Systems wird durch die folgende Gleichung gegeben.
PH = -Log10 [H+]
Es gibt Indikatoren, die als pH-Indikatoren bekannt sind, die verwendet werden, um den Endpunkt einer Säure-Base-Reaktion anzuzeigen. Diese Indikatoren sind in der Lage, die Farbe des Reaktionsmediums mit den pH -Veränderungen zu ändern. Zum Beispiel hat der Phenolphthalein -Indikator eine rosa Farbe in den grundlegenden pH -Werten (ungefähr pH = 10.0), aber es ist bei ungefähr pH = 8 farblos.3.
Was ist poh?
POH ist ein Maß für das Hydroxidion (OH-) Konzentration. Daher ist Poh ein Maß für die Alkalität einer Lösung. Das „P“ im Begriff Poh bezieht sich auf den negativen Logarithmus. Daher ist der POH der negative Logarithmus der Hydroxidionenkonzentration in einer Lösung.
PH = -Log10 [OH-]
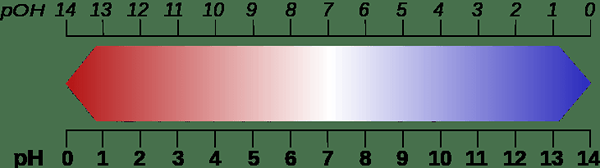
Abbildung 02: Vergleich von pH- und POH -Skalen
Da dieser Begriff die Anzahl der in einer wässrigen Lösung vorhandenen Hydroxidionen angibt, ist er ein Maß für die Basizität (Alkalität). Zum Beispiel schätzt POH weniger als poh = 7 (bei 25ÖC) sind alkalisch. Wenn eine Lösung zwischen 1 und 6 einen POH -Wert hat, ist die Lösung alkalischer. poh = 7 wird als neutral angesehen. POH -Werte höher als 7 werden jedoch als saure Bedingungen erkannt.
Wie ist die Beziehung zwischen pH und poh?
Für die Dissoziation von Wasser ist die Dissoziationskonstante wie unten angegeben.
H2O ⇆ h+ + OH-
Kw = [H+][OH-]
Wobei kW Wasserkonstante ist, [h+] ist Wasserstoffionenkonzertation und [OH-] Ist die Hydroxidionenkonzentration. Aber für reines Wasser, [h+] = [Oh-] = 1 × 10-7mol/l. Dann, wenn die negativen Logarithmen für jeden Term in der obigen Gleichung aufgenommen werden,
pkw = ph + poh
pkw = 7 + 7
PKW = 14
Wenn dann nur der pH -Wert bekannt ist, kann der POH -Wert über die obige Beziehung erhalten werden.
Sowohl in PH- als auch in POH -Skalen ist 7 jedoch neutral.
Was ist der Unterschied zwischen pH und poh?
Ph gegen Poh | |
| PH exprimiert die Säure oder Alkalität einer Lösung auf einer logarithmischen Skala, auf der 7 neutral ist. | POH ist ein Maß für das Hydroxidion (OH-) Konzentration. poh = 7 wird als neutral angesehen |
| Ausdruck | |
| PH gibt den negativen Logarithmus der Wasserstoffionenkonzentration an. | POH gibt den negativen Logarithmus der Hydroxidionenkonzentration an. |
| Saure Werte | |
| Die pH -Skala ergibt saure Werte von 1 bis 6. | Die POH -Skala gibt saure Werte von 8 bis 14 an. |
| Alkalische Werte | |
| Die pH -Skala gibt Grundwerte von 8 bis 14 an. | Die POH -Skala gibt Grundwerte von 1 bis 6 an. |
Zusammenfassung - Ph vs poh
PH und POH sind zwei Begriffe, mit denen die Säure oder Alkalität einer Lösung ausdrückt werden. Der Hauptunterschied zwischen pH und poh besteht darin, dass pH ein Maß für Wasserstoffionen ist, während POH ein Maß für Hydroxidionen ist.
Laden Sie den PDF von PH vs POH herunter
Sie können die PDF -Version dieses Artikels herunterladen und sie für Offline -Zwecke gemäß Citation Note verwenden. Bitte laden Sie die PDF -Version hier herunter: Unterschied zwischen PH und POH
Referenz:
1.Helmenstine, Anne Marie, D. „POH Definition (Chemie).”Thoughtco, Jul. 24, 2017. Hier verfügbar
2.Helmenstine, Anne Marie, D. „Wie man POH in Chemie findet.”Thoughtco, Jan. 29, 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.'Power of Wasserstoff (Ph) Chart'by Hans Kirkendoll - eigene Arbeit, (Public Domain) über Commons Wikimedia
2.'PHSCALENOLANG'BY PHSCALENOLANG.PNG - eigene Arbeit (CC BY -SA 2.5) über Commons Wikimedia


