Unterschied zwischen primären und sekundären Zellen
Schlüsselunterschied - primäre und sekundäre Zellen
Batterien werden verwendet, wenn die Lagerung von Stromstrom benötigt wird. Sie sammeln und verschenken elektrische Ladungen als elektrischer Strom, wenn er erforderlich ist. Batterien bestehen entweder aus primären oder sekundären Zellen. Der Schlüsselunterschied zwischen primären und sekundären Zellen ist die Wiederverwendbarkeit. Sekundärzellen können immer wieder wiederverwendet werden, während die primären Zellen nur einmal verwendet werden können. Der Zweck und die an den Akku angeschlossene Last hängen davon ab, welche Zellentypen im Inneren. Es kann einen oder mehrere Zellen eines einzelnen Typs in einer Batterie geben. Das entscheidet die Spannung oder mit anderen Worten die elektromotive Kraft (EMF) dieser Batterie. Jede Zelle besteht aus 3 Hauptteilen; nämlich Anode, Kathode und Elektrolyt.
Was sind primäre Zellen?
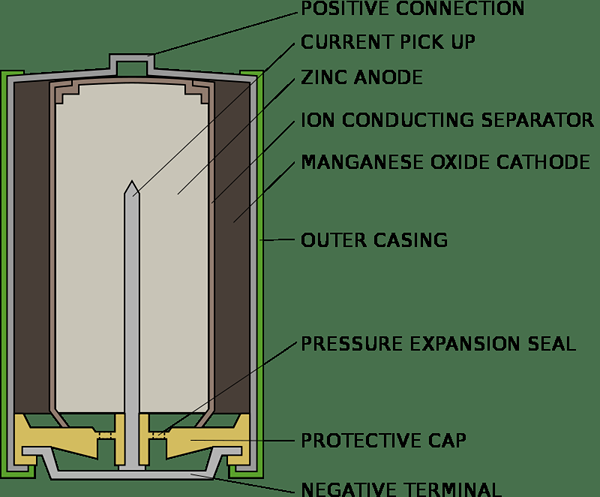
Primärzellen können einmal verwendet und verworfen werden. Sie können nicht aufgeladen und wiederverwendet werden. Die Markierung einer primären Zelle besagt immer, dass sie nicht aufgeladen werden sollte, weil es schädlich ist, aufzuladen, und kann explodiert werden, wenn dies explodiert werden kann, wenn dies explodiert werden kann. Trockenzellen- und Quecksilberzellen sind Beispiele für Primärzellen. Primärzelle ist im Wesentlichen eine chemische Zelle und erzeugt einen elektrischen Strom durch eine irreversible chemische Reaktion. Sobald die Reaktion abgeschlossen ist, kann sie nicht wiederhergestellt werden. Für einen Augenblick besteht eine trockene Zelle aus einer von NH umgebenen Kohlenstoffkathode4Cl in einem Zinkbehälter. Eine Paste von NH4CL und Zncl2 dient als Elektrolyt, während der Zinkbehälter als Anode fungiert. Eine kleine Menge MNO2 wird auch mit dem Elektrolyten gemischt. Der chemische Prozess einer trockenen Zelle kann wie folgt zusammengefasst werden
Zn-> Zn2++2 Elektronen (Anodenreaktion)
NH4+ + Mno2 + Elektronen -> Mno (OH) + NH3 (Kathodenreaktion)
Primärzellen werden häufig in den meisten elektrischen Spielzeugen, Uhren, Handgelenkuhren und inländischen Fernbedienern gefunden und verwendet.

Was sind Sekundärzellen?
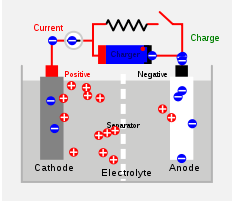
Sekundärzelle ist auch eine chemische Zelle, kann aber wieder aufgeladen werden, um wieder zu verwenden. Die chemische Reaktion, die Elektrizität erzeugt. Die Zelle kann wiederverwendet werden, aber die Lebensdauer wird verkürzt. Blei- und Lebenszelle sind einige Beispiele für Sekundärzellen. In einem Blei-Säure-Zelle, Lead fungiert als Anode und ein Gitter mit Blei, der mit Bleidioxid gepackt ist. Schwefelsäure wird gefüllt, um als Elektrolyt zu dienen. Chemische Reaktionen in einer Blei-Säure-Zelle sind unten angegeben. Sie sind reversible Prozesse.
Pb+so42- --> PBSO4 + 2 Elektronen (Anodenreaktion)
Pbo2 + 4H+ + SO42- + 2 Elektronen -> PBSO4 + 2H2O (Kathodenreaktion)
Moderne Hybridfahrzeuge werden sowohl von Erdöl als auch von elektrischer Leistung angetrieben. Die Batterie lädt sich beim Umzug des Autos auf. Alle Akku in diesen Automobilen bestehen aus Sekundärzellen. Eine weitere häufige Verwendung für Sekundärbatterien ist das Starten, Beleuchtung und Zündung in Fahrzeugen. Außerdem werden sie in ununterbrochenen Stromversorgungen (UPSS), Telekommunikation und tragbaren Tools verwendet.
Was ist der Unterschied zwischen primären und sekundären Zellen?
Kosteneffektivität:
Verwendung Primärzellen ist im Vergleich zu Sekundärzellen anfangs kostengünstig.
Aber benutze Sekundärzellen Wäre eine langfristige Investition, da Primärzellen nach einiger Zeit durch einen anderen Satz ersetzt werden sollen.
Selbstentladungsrate:
Primärzellen haben eine niedrigere Selbstentladungsrate, daher sind sie für Standby-Funktionsgeräte geeignet, die lange Zeit kleine Ströme benötigen. Es ist eine wichtige Tatsache für Sicherheitsausrüstung wie Rauch-/ Feuerdetektoren, Einbrecheralarme und Uhren.
Sekundärzellen eine höhere Selbstentladung haben.
Kosten und Verwendung:
Primärzellen sind billig und einfach zu bedienen.
Sekundärzellen sind teuer und komplexer im Gebrauch.
Bild mit freundlicher Genehmigung:
1. "Alkaline-Batterie-englisch" von Tympanus [Public Domain] über Commons
2. Sekundärzelldiagramm des ursprünglichen Autors: Barrie Lawson. [CC BY-SA 3.0] über Wikimedia Commons


