Unterschied zwischen Natriumchlorid und Natriumnitrat

Der Schlüsselunterschied Zwischen Natriumchlorid und Natriumnitrat ist das Natriumchlorid ist eine Kombination aus Natriumkation und Chloridanion, während Natriumnitrat eine Kombination aus Natriumkation und Nitratanion ist.
Sowohl Natriumchlorid als auch Natriumnitrat sind ionische Verbindungen. Sie haben ein Kation und ein Anion, die durch eine ionische Bindung kombiniert werden. Sie haben unterschiedliche chemische und physikalische Eigenschaften, weil sie unterschiedliche Anionen mit ähnlichen Kationen (Natriumkationen) haben.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Natriumchlorid
3. Was ist Natriumnitrat
4. Seite für Seitenvergleich - Natriumchlorid gegen Natriumnitrat in tabellarischer Form
5. Zusammenfassung
Was ist Natriumchlorid?
Natriumchlorid ist eine anorganische Verbindung aus Natriumkation und Chloridanion. Die chemische Formel dieser Verbindung ist NaCl. Gemeinsam ist es „Salz“, da das Salz, das wir als Lebensmittelzusatz konsumieren, hauptsächlich Natriumchlorid zusammen mit einigen Spurenverbindungen wie Magnesiumchlorid enthält.
Natriumchlorid ist eine ionische Verbindung. Es hat 1: 1 Natriumionen und Chloridionen. Natriumchlorid ist die Verbindung, die für den charakteristischen Geschmack im Meerwasser verantwortlich ist. Das Formelgewicht von Natriumchlorid beträgt 58.44 g/mol. Natriumchlorid ist weiß, wenn es rein ist. Es erscheint als transparente oder durchscheinende kubische Kristalle. Der Schmelzpunkt von Natriumchlorid ist 801ÖC, während der Siedepunkt 1465 istÖC. Es ist gut löslich im Wasser. In der Kristallstruktur von Natriumchlorid ist jedes Ion von sechs Ionen entgegengesetzter Ladung umgeben. Diese Ionen befinden sich in einer regulären Oktaederstruktur.
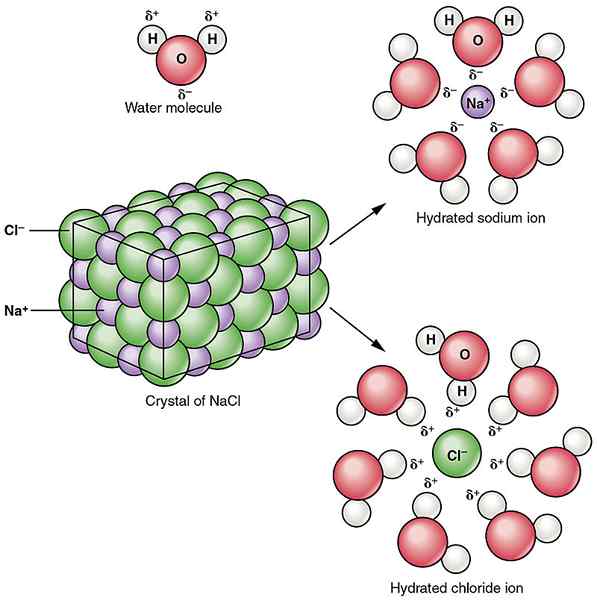
Abbildung 01: Dissoziation von Natriumchlorid in Wasser
Natriumchlorid ist hygroskopisch. Das heißt, es kann Wasserdampf aus der Luft absorbieren, wenn es der Atmosphäre ausgesetzt ist. Außerdem ist diese Verbindung für uns essentiell, das elektrolytische Gleichgewicht in unserem Körper aufrechtzuerhalten. Es wird auch verwendet, um einige Lebensmittel zu erhalten.
Was ist Natriumnitrat?
Natriumnitrat ist eine anorganische Verbindung mit einem Natriumkation und einem Nitratanion. Es hat die chemische Formel Nano3. Es erscheint als weißfarbloser kristalliner Feststoff. Es handelt. Diese Verbindung ist sehr wasserlöslich. Bei der Auflösung bildet es Natriumkationen und Nitratanionen. Daher ist es nützlich als leicht nitratierter verfügbarer Quelle in verschiedenen Syntheseprozessen, Düngemittelproduktion usw.

Abbildung 02: Natriumnitratkristalle
Die Molmasse von Natriumnitrat beträgt 84.9 g/mol. Es hat einen süßen Geruch. Neben dem Bergbau aus Einlagen können wir auch Natriumnitrat im Labor synthesen. Dort können wir Salpetersäure mit Natriumcarbonat oder Natriumbicarbonat neutralisieren. Es ist auch möglich, diese Neutralisation mit Natriumhydroxid durchzuführen. Die Kristallstruktur dieses erzeugten Natriumnitrat.
Was ist der Unterschied zwischen Natriumchlorid und Natriumnitrat?
Der Schlüsselunterschied zwischen Natriumchlorid und Natriumnitrat besteht darin. Die chemische Formel von Natriumchlorid ist NaCl, während die chemische Formel von Natriumnitrat Nano ist3.
Die folgende Infografik fasst den Unterschied zwischen Natriumchlorid und Natriumnitrat zusammen.

Zusammenfassung -Natriumchlorid gegen Natriumnitrat
Natriumchlorid und Natriumnitrat sind ionische Verbindungen. Der Schlüsselunterschied zwischen Natriumchlorid und Natriumnitrat besteht darin.
Referenz:
1. Helmenstine, Anne Marie. „Was ist Tischsalz?”Thoughtco, Februar. 11, 2020, hier erhältlich.
2. Helmenstine, Anne Marie. „Wie man Natriumnitratkristalle anbaut.”Thoughtco, Februar. 11, 2020, hier erhältlich.
3. "Natriumnitrat.Nationales Zentrum für Biotechnologieinformationen. Pubchem Compound -Datenbank, u.S. National Library of Medicine, hier verfügbar.
4. „Natriumchlorid.Nationales Zentrum für Biotechnologieinformationen. Pubchem Compound -Datenbank, u.S. National Library of Medicine, hier verfügbar.
Bild mit freundlicher Genehmigung:
1. "214 Dissoziation von Natriumchlorid in Water -01" vom OpenStax College - Anatomy & Physiology, Connexions -Website, 19. Juni 2013 (CC von 3.0) über Commons Wikimedia
2. "Natriumnitratkristalle" von Vadim Sedov - eigene Arbeit (CC von 4.0) über Commons Wikimedia


