Unterschied zwischen Arten und Phase in Lösung
Der Schlüsselunterschied Zwischen Arten und Phase in Lösung ist das Spezies einer Lösung bezieht sich auf die in der Lösung vorhandenen chemischen Komponenten, während Phase in einer Lösung sich auf die sichtbar unterschiedlichen Formen von Substanzen bezieht, die in einer Lösung vorhanden sind.
Eine Lösung ist eine Mischung aus Lösungsmittel und Stoff (en). Die gelösten Stoffe werden im Lösungsmittel aufgelöst. Einige gelöste Stoffe lösten sich im Lösungsmittel auf, während andere sich durch Ionisation auflösen. Daher hängt die in der Lösung vorhandene Spezies von der Ionisierungsfähigkeit der Verbindung im Lösungsmittel ab. Es gibt zwei Arten von Lösungen als homogene Lösungen und heterogene Lösungen, abhängig von der Phase der Angelegenheit.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind Arten in Lösung
3. Was ist eine Phase in Lösung
4. Seite an Seitenvergleich -Spezies gegen Phase in Lösung in tabellarischer Form
5. Zusammenfassung
Was sind Arten in Lösung?
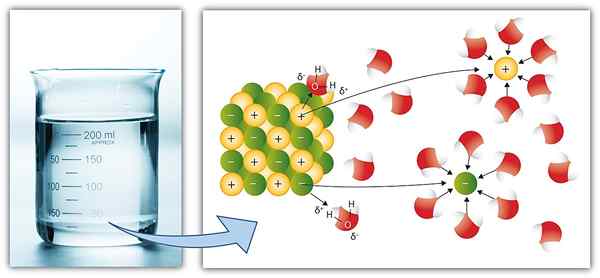
Spezies in einer Lösung bezieht sich auf die chemischen Komponenten, die sich aus der Auflösung eines gelösten Stoffes in einem Lösungsmittel bilden. Einige Arten lösten sich im Lösungsmittel auf, wie sie sind. Beispielsweise bildet die Glukoseauflösung eine wässrige Glukoselösung, die Glukosemoleküle enthält, die keine Veränderung durchlaufen haben. Hier sind die chemischen Spezies in der Lösung die Glukosemoleküle.
Manchmal lösen sich ionische Verbindungen im Lösungsmittel durch Ionisation auf. Das bedeutet; Die Verbindung dissoziiert nach Auflösung im Lösungsmittel in ihre ionischen Komponenten. In diesem Fall sind die in der Lösung vorhandenen chemischen Spezies die ionischen Komponenten, nicht das gelöste Molekül. Daher kann die Spezies in der Lösung je nach Ionisationsfähigkeit des gelösten Stoffes variieren.

Abbildung 01: Ionische Spezies im Wasser
Bei der Erläuterung der Eigenschaften einer Lösung ist es wichtig, die in der Lösung vorhandenen chemischen Spezies zu kennen. Wenn wir beispielsweise die Konzentration einer Lösung exprimieren, beziehen wir uns normalerweise auf die Konzentration des gelösten gelösten gelösten oder ionen. Darüber hinaus sind der Siedepunkt der Lösung, die Löslichkeit einer anderen Komponente in einer Lösung und viele andere Lösungseigenschaften von den in der Lösung vorhandenen Spezies abhängig.
Was ist Phase in Lösung?
Phase in einer Lösung bezieht sich auf das Vorhandensein oder Fehlen einer oder mehrerer Phasen der Materie in derselben Lösung. Hier können wir Lösungen in zwei Typen als homogene Lösungen und heterogene Lösungen kategorisieren.

Abbildung 02: Milch ist eine heterogene Lösung
Eine homogene Lösung wird auch als einphasige Lösung bezeichnet, da sie in derselben Phase all ihre Materie hat. Das heißt, die gelösten Stoffe und Lösungsmittel sind in derselben Phase, und wir können in diesen Lösungen verschiedene Phasen nicht beobachten. Im Gegensatz dazu sind heterogene Lösungen mehrfache Lösungen. Das ist; Diese Lösungen haben zwei oder mehr Phasen in derselben Lösung. Zum Beispiel haben Emulsionen eine flüssige und feste Phase in derselben Lösung.
Was ist der Unterschied zwischen Arten und Phase in Lösung?
Der Schlüsselunterschied zwischen Spezies und Phase in der Lösung besteht darin, dass sich Arten einer Lösung auf die in der Lösung vorhandenen chemischen Komponenten beziehen, während Phase in einer Lösung sich auf die sichtbar unterschiedlichen Formen von Substanzen bezieht, die in einer Lösung vorhanden sind. Darüber hinaus sind Moleküle oder Ionen die Komponenten einer Spezies in einer Lösung, während flüssige und feste Phasen die Komponenten einer Spezies in einer Lösung sind.
Die folgende Infografik fasst den Unterschied zwischen Arten und Phase in Lösung zusammen.

Zusammenfassung -Spezies gegen Phase in Lösung
Eine Lösung ist eine Mischung aus Lösungsmittel und Stoff (en). Der gelöste (en) gelöst im Lösungsmittel gelöst. Die Spezies in Lösung und Phase in Lösung sind wichtige Begriffe, wenn die Eigenschaften einer Lösung ausgedrückt werden. Der Schlüsselunterschied zwischen Spezies und Phase in Lösung besteht darin, dass sich Arten einer Lösung auf die in der Lösung vorhandenen chemischen Komponenten beziehen, während Phase in einer Lösung sich auf die sichtbar unterschiedlichen Formen von Substanzen bezieht, die in einer Lösung vorhanden sind.
Referenz:
1. Helmenstine, Anne Marie. „Der Unterschied zwischen heterogenen und homogenen Gemischen.”Thoughtco, Jan. 29, 2020, hier erhältlich.
2. „Thermodynamische Aktivität.Wikipedia, Wikimedia Foundation, 4. Oktober. 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Natriumchloridauflösung" von Andy Schmitz - 2012 Bucharchiv (CC von 3.0) über Commons Wikimedia
2. "Niedliche kleine Milch" von Hobvias Sudoneighm (CC von 2.0) über Flickr


